题目内容
用CH4催化还原NOx可以消除氮氧化物的污染。例如:
① CH4 (g)+4NO2(g)=4NO(g) +CO2(g)+2H2O(g) △H=-574 kJ·mol-1;
② CH4 (g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ·mol-1。下列说法不正确的是
- A.由反应①、②可推知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)ΔH=-867 kJ·mol-1
- B.等物质的量的甲烷分别参与反应①、②,则反应转移的电子数相等
- C.若用标准状况下4.48 L CH4还原NO2至N2,放出的热量为173.4 kJ
- D.若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为3.2NA
D
根据盖斯定律可知,(①+②)÷2即得到CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867 kJ·mol-1,选项A正确。
甲烷在反应中都是失去8个电子的,B正确。
标准状况下4.48 L CH4是0.2mol,所以放出的热量是867 kJ×0.2=173.4 kJ,C正确。
0.2mol甲烷失去1.6mol电子,D不正确。
答案选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 (2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.
(2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.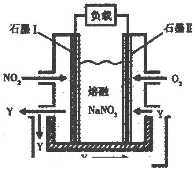
 汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.
汽车内燃机工作时产生的高温会引起N2和O2发生反应生成NO气体,是导致汽车尾气中含有NO的原因之一.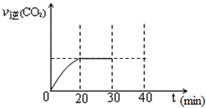 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.