题目内容
6.A、B、C、D、E都是短周期元素,原子序数依次增大,A、B处于同一周期,C、D、E同处另一周期.C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙.D、A按原子个数比3:2形成离子化合物丙.E是地壳中含量最高的金属元素.根据以上信息回答下列问题:(1)B元素在周期表中的位置是第二周期、第ⅥA族,乙物质的电子式是
 •
•(2)A、B、C、D、E五种元素的原子半径由小到大的顺序是O<N<Al<Mg<Na(用元素符号填写).
(3)E的单质加入到C的最高价氧化物对应的水化物的溶液中,发生反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
分析 A、B、C、D、E都是短周期元素,原子序数依次增大,C、D、E同处另一周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C为钠元素,B为氧元素,甲为氧化钠,乙为过氧化钠,E是地壳中含量最高的金属元素,则E为铝元素,A、B、C、D的原子序数都小于铝,D、A按原子个数比3:2形成离子化合物丙,A、B处于同一周期,则A为氮元素,D为镁元素,化合物丙为Mg3N2,据此答题.
解答 解:A、B、C、D、E都是短周期元素,原子序数依次增大,C、D、E同处另一周期,C、B可按原子个数比2:l和1:1分别形成两种离子化合物甲和乙,则C为钠元素,B为氧元素,甲为氧化钠,乙为过氧化钠,E是地壳中含量最高的金属元素,则E为铝元素,A、B、C、D的原子序数都小于铝,D、A按原子个数比3:2形成离子化合物丙,A、B处于同一周期,则A为氮元素,D为镁元素,化合物丙为Mg3N2,
(1)B为氧元素,位于周期表中第二周期、第ⅥA族,乙为过氧化钠,其电子式为 ,
,
故答案为:第二周期、第ⅥA族; ;
;
(2)电子层越多,半径越大,同周期从左向右原子半径在减小,则原子半径为O<N<Al<Mg<Na,
故答案为:O<N<Al<Mg<Na;
3)C的最高价氧化物对应的水化物的溶液为NaOH,与Al反应的离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置、结构、性质,明确元素的推断是解答本题的关键,并熟悉化学用语的使用来解答即可,题目难度不大.

练习册系列答案
相关题目
16.为了使鱼苗顺利运输,必须满足三个条件:①需要保持适量的氧气;②使鱼苗呼出的二氧化碳及时排出;③防止细菌大量繁殖.已知下述四种物质加入水中都可起到供氧灭菌作用.在长距离运输鱼苗的水中,最好加入( )
| A. | 过氧化钠 | B. | 氯水 | C. | 过氧化钙 | D. | 双氧水 |
17.下列离子方程式正确的是( )
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 用食醋除去热水瓶胆中的Mg(OH)2水垢:2H++Mg(OH)2═Mg2++2H2O | |
| C. | 将少量SO2气体通往通往NaClO溶液中:SO2+2ClO-+H2O═SO32-+2HClO | |
| D. | 在硫酸氢钾溶液中加入氢氧化钡溶液至pH=7:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O |
14.常温常压下,下列各组气体能共存的是( )
| A. | SO2和O2 | B. | NO和O2 | C. | H2S和SO2 | D. | NH3和HCl |
11.下列原子中的未成对电子数为1的是(单独占据1个原子轨道的电子称为未成对电子)( )
| A. | N | B. | F | C. | O | D. | S |
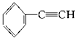 炔烃
炔烃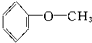 醚
醚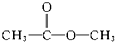 酯
酯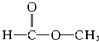 酯
酯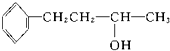 醇
醇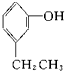 酚
酚 1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )
1866年凯库勒(如图)提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释下列事实( )