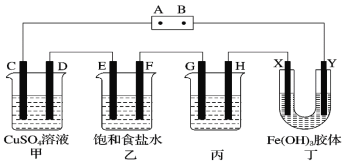
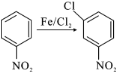
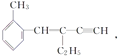
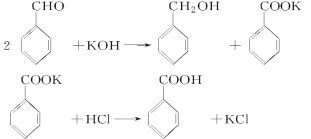
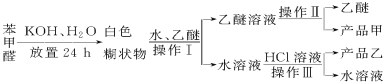
题目内容
【题目】亚铁氰化钾(K4[Fe(CN)6])双称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)基态Fe3+电子填充的最高能级符号为___________。
(2)K4[Fe(CN)6]中的作用力除离子键和共价键外,还有___________。含有12 mol σ键的KFe[Fe(CN)6]的物质的量为___________mol。
(3)黄血盐中N原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________,与CN-互为等电子体的分子是________,离子是________。
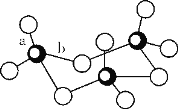
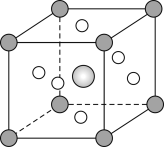
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是_____________。
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_______g/cm3。
【答案】3d 配位键 1 sp N>O>C N2 ![]() K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高
K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高 ![]()
【解析】
(1)Fe原子核外有26个电子,失去3e得到Fe3+,基态Fe3+的核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5,电子填充的最高能级为3d,
故答案为:3d;
(2)K4[Fe(CN)6]是离子化合物,存在离子键,其中Fe(CN)![]() 含有共价键和配位键,即化学键为离子键、配位键和共价键;1个Fe(CN)
含有共价键和配位键,即化学键为离子键、配位键和共价键;1个Fe(CN)![]() 中含有6个配位键,CN中含有C≡N,1个C≡N中含有1个
中含有6个配位键,CN中含有C≡N,1个C≡N中含有1个![]() 键、2个
键、2个![]() 键,即1个Fe(CN)
键,即1个Fe(CN)![]() 中含有12个
中含有12个![]() 键,所以含有12molσ键的K4[Fe(CN)6的物质的量为1mol,
键,所以含有12molσ键的K4[Fe(CN)6的物质的量为1mol,
故答案为:配位键;1;
(3)CN中中心原子C的价层电子对数=![]() =2,即CN的VSEPR模型为直线型,采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O第一电离能大小顺序为N>O>C;CN-含有2个原子,价电子数为10,与CN-互为等电子体的分子有氮气,离子有
=2,即CN的VSEPR模型为直线型,采用sp杂化;同一周期元素第一电离能随着原子序数增大而呈增大趋势,但是第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O第一电离能大小顺序为N>O>C;CN-含有2个原子,价电子数为10,与CN-互为等电子体的分子有氮气,离子有![]() ,
,
故答案为:sp杂化;N>O>C;N2;![]() ;
;
(4)①K和Na都为金属晶体,Li原子半径小于Na原子半径,对核外电子的吸引能力更强,金属键更强,熔点更高;
故答案为:K和Na的价电子数相同,但Na原子半径小于K原子半径,所以Na金属键更强,熔点更高;
②设晶胞的边长为x,则4r=![]() x,则x=
x,则x=![]() cm,晶胞体积V=x3cm3=
cm,晶胞体积V=x3cm3=![]() cm3,该晶胞中Fe原子数为
cm3,该晶胞中Fe原子数为![]() ,m(晶胞)=nM=
,m(晶胞)=nM=![]() ×ag,晶胞密度ρ=
×ag,晶胞密度ρ=![]() =
=![]() g/cm3=
g/cm3=![]() ,
,
故答案为:![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】I.贮氢合金ThNi5可催化由CO、H2合成CH4等有机化工产品的反应。温度为TK时发生以下反应:2CO(g)+O2(g)=2CO2(g) △H=-566 kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ·mol-1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890 kJ·mol-1
(1)温度为TK时,催化由CO、H2合成CH4反应的热化学方程式为___________。
(2)已知温度为TK时CH4(g)+2H2O(g)=CO2(g)+4H2(g) △H=+165 kJ·mol-1的活化能为485.2kJ/mol,则其逆反应的活化能为________kJ/mol。
II.对于反应CO(g)+H2O(g)CO2(g)+H2(g) △H=-41 kJ·mol-1进行以下研究:
(3)TK时,向一恒压密闭容器中充入等物质的量的CO(g)和H2O(g)发生上述反应,测得CO(g)物质的量分数随时间变化如下表所示:
时间/min | 0 | 2 | 5 | 6 | 9 | 10 |
x(CO) | 0.5 | 0.25 | 0.1 | 0.1 | 0.05 | 0.05 |
若初始投入CO为2 mol,恒压容器容积10 L,用H2O(g)表示该反应0~5分钟内的速率υ(H2O(g)=_____,6分钟时,仅改变一种条件破坏了平衡,则改变的外界条件为___________。
(4)已知700K时,在恒容密闭容器中,充入等物质的量的CO和H2O(g),发生上述反应,平衡CO体积分数为![]() ,则反应的平衡常数K=______。
,则反应的平衡常数K=______。
(5)在400K、500K时进行上述反应,其中CO和H2的分压随时间变化关系如右图所示,催化剂为氧化铁。实验初始时体系中的p(H2O)和p(CO)相等、p(CO2)和p(H2)相等。

400K时p(H2)随时间变化关系的曲线是______,500K时p(CO)随时间变化关系的曲线是_______。(填字母序号)
III.在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g),是合成甲醇的一种方法。
CH3OH(g),是合成甲醇的一种方法。
(6)某温度下,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应CO(g)+2H2(g)![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时υ(正)_______υ(逆)(填“>”“<”或“=”)。下列不能说明该反应已达到平衡状态的是___________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变 c.υ(逆)(CO)=2υ(正)(H2) d.混合气体的密度不再发生改变