题目内容
【题目】水中的溶解氧的含量是衡量水质的一个重要指标,某实验兴趣小组通过如下步骤来测量水中溶解氧的含量: 步骤一:向溶解氧测量瓶中注入20.00mL水样,再分别加入1mL 0.1molL﹣1MnSO4溶液和3mL NaOH和KI的混合溶液,充分反应.此时发生反应的化学方程式为:Mn2++2OH﹣═Mn(OH)2↓ 2Mn(OH)2+O2═2MnO(OH)2
步骤二:向上述混合物中加入1.5mL浓硫酸,充分反应后制沉淀完全溶解,此时溶液呈黄色.
步骤三:将溶液全部转移到容量瓶中,向其中滴加23滴淀粉溶液,溶液呈蓝色.用 0.005molL﹣1的Na2S2O3标准溶液滴定至蓝色恰好消失,共消耗Na2S2O3标准溶液3.60mL.此时发生反应为:I2+2Na2S2O3═2NaI+Na2S4O6
(1)25℃时,步骤一中当加入NaOH使溶液的pH=12时,此时溶液中的c(Mn2+)=molL﹣1 . (已知 KspMn(OH)2=2.06×10﹣13)
(2)写出步骤二中所发生反应的化学方程式:
(3)计算该水样中溶解氧的含量.(单位:mgL﹣1 , 请写出计算过程)
【答案】
(1)2.06×10﹣9
(2)MnO(OH)2+2H2SO4+2KI=MnSO4+K2SO4+I2+3H2O
(3)解:由化学方程式可知:O24Na2S2O3,
n(O2)= ![]() ×0.005molL﹣1×3.60×10﹣3L=4.5×10﹣6mol
×0.005molL﹣1×3.60×10﹣3L=4.5×10﹣6mol
溶解氧的含量═4.5×10﹣6mol×16g/mol× ![]() =7.2g/L=7.2 mgL﹣1,
=7.2g/L=7.2 mgL﹣1,
答:该水样中溶解氧的含量为7.2 mgL﹣1
【解析】解:(1)加入NaOH使溶液的pH=12时,c(H+)=10﹣12mol/L,c(OH﹣)=10﹣2mol/L,结合 KspMn(OH)2=2.06×10﹣13计算,KspMn(OH)2=c(Mn2+)c2(OH﹣)=2.06×10﹣13计算得到:c(Mn2+)=2.06×10﹣9 , 所以答案是:2.06×10﹣9;(2)向溶解氧测量瓶中注入20.00mL水样,再分别加入1mL 0.1molL﹣1MnSO4溶液和3mL NaOH和KI的混合溶液,充分反应.此时发生反应的化学方程式为:Mn2++2OH﹣═Mn(OH)2↓ 2Mn(OH)2+O2═2MnO(OH)2 , 向上述混合物中加入1.5mL浓硫酸,充分反应后制沉淀完全溶解,此时溶液呈黄色,说明MnO(OH)2 氧化KI生成碘单质,反应的化学方程式为:MnO(OH)2+2H2SO4+2KI=MnSO4+K2SO4+I2+3H2O,
所以答案是:MnO(OH)2+2H2SO4+2KI=MnSO4+K2SO4+I2+3H2O;

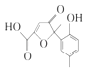
【题目】根据所给的信息和标志,判断下列说法不正确的是( )
A | B | C | D |
|
|
|
|
古代中国人已用麻黄治疗咳嗽 | 用于杀菌消毒和衣物的洗涤漂白 | 不可以用氢氧化钠溶液将其溶解 | 废纸、塑料、玻璃、金属均可回收 |
A.A
B.B
C.C
D.D