题目内容
【题目】25℃时,向20mL0.0100mol/L苯酚溶液中滴加0.0100 mol/LNaOH溶液,溶液的pH与所加NaOH溶液体积(V)的关系如图所示。下列说法正确的是( )
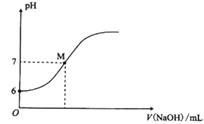
A.25℃时,苯酚的电离常数Ka约为1.0×10-12
B.M点时,所加入NaOH溶液的体积大于10 mL
C.加入20 mLNaOH溶液时,溶液中c(OH-)-c(H+)=c(![]() )
)
D.M点时,溶液中的水不发生电离
【答案】C
【解析】
由图象可知 0.0100molL-1苯酚溶液的pH为6,则可知![]() ,可知苯酚为弱酸,M点溶液呈中性,加入
,可知苯酚为弱酸,M点溶液呈中性,加入![]() 20mL时酸碱恰好完全反应。
20mL时酸碱恰好完全反应。
A. 0.0100molL1苯酚溶液的pH为6,则可知![]() ,故A错误;
,故A错误;
B. M点pH=7,溶液呈中性,如加入![]() 体积为10mL,反应后剩余的苯酚和生成的苯酚钠浓度相等,由
体积为10mL,反应后剩余的苯酚和生成的苯酚钠浓度相等,由![]() ,可知苯酚根离子的水解常数为
,可知苯酚根离子的水解常数为![]() ,可知水解程度大于电离常数,溶液呈碱性,如呈中性,则加入
,可知水解程度大于电离常数,溶液呈碱性,如呈中性,则加入![]() 的体积小于10mL,故B错误;
的体积小于10mL,故B错误;
C.加入20mL![]() 溶液时,溶液中存在电荷守恒
溶液时,溶液中存在电荷守恒![]() ,由物料守恒可知
,由物料守恒可知![]() ,则二者联式可得
,则二者联式可得![]() ,即c(OH-)-c(H+)=c(
,即c(OH-)-c(H+)=c(![]() ),故C正确;
),故C正确;
D. 任何水溶液都存在水的电离,故D错误;
答案选C。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目