题目内容
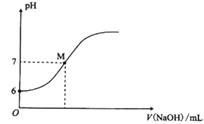
【题目】将V1 mL 1.00 mol·L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是
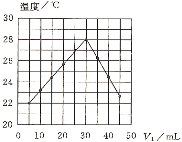
A.做该实验时环境温度为22℃B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是0.67 mol·L-1D.该实验表明有水生成的反应都是放热反应
【答案】B
【解析】
A.温度为22℃时加入盐酸5mL,因此不是实验温度,A项错误;
B. 酸碱中和反应将化学能转化为热能,B项正确;
C. 根据方程式可知n(HCl)=n(NaOH),即V1 mL×1.00 mol·L-1= V2 mL×c(NaOH),参加反应的盐酸为30mL,则c(NaOH)=![]() =1.5mol/L,C项错误;
=1.5mol/L,C项错误;
D. 只能判断盐酸和氢氧化钠溶液反应生成氯化钠和水,其他有水生成的反应不一定是放热反应,D项错误;
答案选B。

【题目】氮、磷、钾是农作物生长的必须营养元素,磷和钙都是促成骨骼和牙齿的钙化不可缺少的营养元素。回答下列问题:
(1)基态K的核外电子排布式为____________,基态N的价电子排布图为____________。
(2)元素的第一电离能:Ca________(填“>”或“<”)P。
(3)白磷P4在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度,N4是氮的一种新型单质,若N4分子结构类似于白磷P4,则N的杂化方式为________。
(4)下表是几种碳酸盐的热分解温度和阳离子半径:
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
根据上表数据分析碳酸钡分解温度最高的原因是_______________________
(5)常温下PCl5是一种白色晶体,晶体结构为氯化铯型,由A、B两种离子构成。已知A、B两种离子分别与CCl4、SF6互为等电子体,则A、B两种离子的符号分别为________、________。
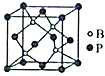
(6)用晶体的X射线衍射法可以测得阿伏加德罗常数的值。已知金属钙的晶胞为面心立方(如图)晶胞,晶胞边长为d pm;又知钙的密度为ρ g/cm3,则一个钙晶胞的质量为________(用d、ρ表示,下同)g,阿伏加德罗常数的值为______________(化成最简式)。