题目内容
【题目】铜及其化合物的用途非常广泛,回答下列问题:
(1)基态铜原子有种不同运动状态的电子,二价铜离子的电子排布式为________。
(2)铜能与类卤素(CN)2反应生成Cu(CN)2 1mol(CN)2分子中含有π键的数目为___________。
(3)CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写),结构如图所示,
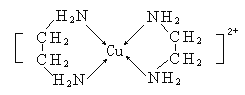
则Cu2+的配位数为_________,该配离子中所含的非金属元素的电负性由大到小的顺序是________;乙二胺分子中氮原子轨道的杂化类型为______,乙二胺和三甲胺[N(CH3)3]均属于胺,但相对分子质量相近,但乙二胺比三甲胺的沸点高的多,原因是__________。
(4)铜晶体中铜原子的堆积方式为面心立方堆积,每个铜原子周围距离最近的铜原子数目为________。
(5)某M原子的外围电子排布是为3s23p5,铜与M形成化合物的晶胞如图所示(黑球代表铜原子)。
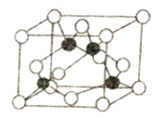
①已知铜和M的电负性分别为1.9和3.0,则铜与M形成的该种化合物属于________ (填“离子”或“共价”)化合物。
②已知该晶体的密度为ρg·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为______pm(只写计算式)。
【答案】 1s22s22p63s23p63d9[Ar]3d9 4NA 4 N>C>H sp3 乙二胺分子之间可以形成氢键,三甲胺分子间不能形成氢键 12 共价 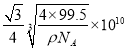
【解析】(1)Cu为29号元素,二价铜离子的电子排布式为:1s22s22p63s23p63d9(或[Ar]3d9);答案为:1s22s22p63s23p63d9或[Ar]3d9
(2) (CN)2分子的结构式为N≡C-C≡N,1个N≡C键中有1个σ键,2个π键,1mol(CN)2分子中含有π键的数目为4NA;答案为:4NA
(3)由结构图可知配离子[Cu(En)2]2+中Cu2+的配位数为4;同周期元素自左向右,电负性逐渐增大,故电负性:N>C,H元素分别与C、N元素化合时,H元素表现正化合价,H元素的电负性比C、N元素的小,故电负性:N>C>H;乙二胺(H2N-CH2-CH2-NH2)中N原子形成3个σ键,含有1对孤对电子对,杂化轨道数为4,采取sp3杂化;乙二胺(H2N-CH2-CH2-NH2)分子之间可以形成氢键,三甲胺[N(CH3)3]分子之间不能形成氢键,故乙二胺的沸点较高;答案为:4 ,N>C>H , sp3 ,乙二胺分子之间可以形成氢键,三甲胺分子间不能形成氢键。
(4)根据面心立方堆积形成的晶胞可知,每个铜原子周围距离最近的铜原子位于经过立方体的面的面心上,共有12个;答案为:12
(5)根据M原子的外围电子排布式为3s23p5可知,M为Cl元素,根据晶胞结构可知,铜原子位于立方体内部,全部属于晶胞,氯原子位于立方体的顶点和面心,所以铜原子个数为4,氯原子个数=8×![]() +6×
+6×![]() =4,所以二者形成的化合物的化学式为CuCl;
=4,所以二者形成的化合物的化学式为CuCl;
①铜和M的电负性相差3.01.9=1.1,电负性差大于1.7的键一般是离子键,小于1.7的一般为共价键,故Cu与M形成的化合物属于共价化合物;
②CuCl的相对分子质量99.5,一个晶胞中含有4个CuCl,所以一个晶胞的摩尔质量为4×99.5g/mol,晶胞的摩尔体积为![]() =
=![]() cm3/mol,晶胞的边长为
cm3/mol,晶胞的边长为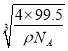 cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体对角线长的
cm,根据晶胞的结构可知,铜原子和M原子之间的最短距离为立方体对角线长的![]() ,而体对角线为晶胞边长的
,而体对角线为晶胞边长的![]() 倍,所以铜原子和M原子之间的最短距离为:
倍,所以铜原子和M原子之间的最短距离为: 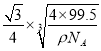 cm=
cm=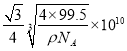 pm。答案为:共价 ,
pm。答案为:共价 , 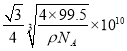

【题目】一定温度下,在三个等体积的恒容密闭容器中,反应2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
C2H5OH(g)+3H2O(g)达平衡,下列说法正确的是
容器 | 温度/K | 物质的起始浓度(mol/L) | 物质的平衡浓度(mol/L) | |||
CO2(g) | H2(g) | C2H5OH(g) | H2O(g) | C2H5OH(g) | ||
甲 | 500 | 0.20 | 0.60 | 0 | 0 | 0.083 |
乙 | 500 | 0.40 | 1.20 | 0 | 0 | |
丙 | 600 | 0 | 0 | 0.10 | 0.30 | 0.039 |
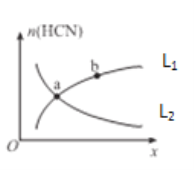
A. 该反应正反应为吸热反应
B. 达平衡时,容器甲中的逆反应速率比容器乙中的小
C. 达平衡时,转化率:α(CO2 ,甲)+α(C2H5OH ,丙)>1
D. 达平衡时,甲、乙容器内:2c(CO2 ,甲)<c(CO2 ,乙)