题目内容
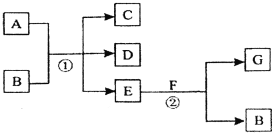
【题目】在下列各变化中,反应①为常温下的反应,A、C、D均含氯元素,且A中氯元素的化合价介于C与D之间,E常温下为无色无味的液体,F为淡黄色粉末,G为常见的无色气体。
回答下列问题:
(1)A、G的化学式分别为________________、 ________________。
(2)F和E反应的化学方程式为____________________________。
(3)写出反应①的化学方程式____________________________________。
(4)在反应②中,每生成2.24 L气体G(标准状况)时,消耗F ___________g。
【答案】Cl2 O2 2Na2O2 +2H2O = 4NaOH + O2 Cl2+2NaOH=NaCl+NaClO+H2O 15.6
【解析】
E常温下为无色无味的液体,推测E为水,F为淡黄色粉末,推测为过氧化钠,由图中关系可推知:A:Cl2;B:NaOH;C:NaCl;D:NaClO;E:H2O;F:Na2O2;G:O2。
在结合反应①②的情况,即可推断反应①为:Cl2+2NaOH=NaClO+NaCl+H2O,反应②为2Na2O2+2H2O=4NaOH+O2↑,据此解答。
由图中关系可推知:A:Cl2;B:NaOH;C:NaCl;D:NaClO;E:H2O;F:Na2O2;G:O2。
(1)A、G的化学式分别为Cl2、O2。
故答案为:Cl2 ;O2;
(2)F和E反应的化学方程式为2Na2O2 +2H2O = 4NaOH + O2,
故答案为:2Na2O2 +2H2O = 4NaOH + O2;
(3)A和B反应的方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)在反应2Na2O2 +2H2O = 4NaOH + O2↑,每产生标准状况下的氧气22.4L,消耗的Na2O22mol.即156g。现在产生了2.24 L气体G(标准状况),则消耗Na2O2质量为15.6g,
故答案为:15.6。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_________________________________。
(2)该反应的正反应为____________反应(填“吸热”、“放热”)。
(3)某温度下,平衡浓度符合下式:c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______________℃。此温度下加入1molCO2(g)和1molH2(g),充分反应,达到平衡时,CO2的转化率为__________。
(4)在800 ℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol/L ,c(H2)为1.5mol/L,c(CO)为1mol/L, c(H2O)为3mol/L,则正、逆反应速率的比较为υ正________υ逆 。(填“>”、“<”或“=”)