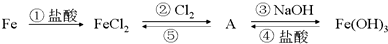题目内容
11.下表是元素周期表的一部分,表中序号分别代表某一元素.请回答下列问题.| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(2)④、⑤的简单离子,其半径更大的是F-(写离子符号).
(3)⑧、⑨的气态氢化物,更稳定的是HCl(填化学式).
(4)元素的非金属性:①>⑦(填“>”或“<”).
(5)①-⑨的最高价氧化物的水化物中:酸性最强的是HClO4(填化学式);
碱性最强的是NaOH(填化学式),它与⑥的最高价氧化物的水化物反应的离子方程式为OH-+Al(OH)3=AlO2-+2H2O.
分析 由元素在周期表的位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar元素.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强;稀有气体原子最外层为稳定结构,化学性质最不活泼;Si为常见的半导体材料;N元素的气态氢化物与其最高价氧化物的水化物可直接化合生成铵盐;
(2)电子层结构相同,核电荷数越大,离子半径越小;
(3)非金属性越强,气态氢化物越稳定;
(4)同主族从上到下非金属性减弱;
(5)高氯酸为含氧酸中酸性最强的酸;短周期中Na的金属性最强,NaOH的碱性最强,与氢氧化铝反应生成偏铝酸钠和水.
解答 解:由元素在周期表的位置,可知①为C、②为N、③为O、④为F、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar.
(1)同周期自左而右金属性减弱、同主族自上而下金属性增强,故上述元素中Na的金属性最强;稀有气体Ar原子最外层为稳定结构,化学性质最不活泼;Si为常见的半导体材料;N元素的气态氢化物与其最高价氧化物的水化物可直接化合生成铵盐,
故答案为:Na;Ar;Si;N;
(2)电子层结构相同,核电荷数越大,离子半径越小,故离子半径:F->Na+,
故答案为:F-;
(3)非金属性Cl>S,非金属性越强,气态氢化物越稳定,则更稳定的为HCl,故答案为:HCl;
(4)同主族从上到下非金属性减弱,则非金属性①>⑦,故答案为:>;
(5)高氯酸为含氧酸中酸性最强的酸,该酸的化学式为HClO4;短周期中Na的金属性最强,其对应碱NaOH的碱性最强,NaOH与氢氧化铝反应生成偏铝酸钠和水,离子反应为OH-+Al(OH)3=AlO2-+2H2O,
故答案为:HClO4;NaOH;OH-+Al(OH)3=AlO2-+2H2O.
点评 本题考查元素周期表与元素周期律应用,需要学生熟练掌握元素周期表的结构与元素符号,注意对元素周期律的理解掌握,有利于基础知识的巩固.

| A. | D元素最高价氧化物对应的水化物化学式H2YO4 | |
| B. | 原子半径由大到小的顺序为:B>D>E | |
| C. | B、C两种元素的气态氢化物中,C的气态氢化物较稳定 | |
| D. | A与B形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
| A. | 核外有13个电子,其中6个能参与成键 | |
| B. | 核内有6个质子,核外有7个电子 | |
| C. | 质量数是13,原子序数是6,核内有7个质子 | |
| D. | 质量数是13,原子序数是6,核内有7个中子 |
 甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
甲~辛等元素在周期表中的相对位置如下表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 原子半径:己>辛>戊 | |
| B. | 辛是金属元素,元素符号为Ge | |
| C. | 丙与庚的原子核外电子数相差13 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物. |
| A. | 苯 | B. | 乙醇 | C. | 乙烷 | D. | 乙烯 |
| A. | 6个碳原子有可能都在一条直线上 | |
| B. | 分子中最多有12个原子在同一平面上 | |
| C. | 6个碳原子有可能都在同一平面上 | |
| D. | 6个碳原子不可能都在同一平面上 |