题目内容
6.绿矾(FeSO4•7H2O)在化学合成上用作还原剂及催化剂.工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾.(1)98% 1.84g/cm3的浓硫酸在稀释过程中,密度下降,当稀释至50%时,密度为1.4g/cm3,50%的硫酸物质的量浓度为7.14mol•L-1(保留两位小数),50%的硫酸与30%的硫酸等体积混合,混合酸的浓度为>(填>、<、=)40%.
(2)将111.2g绿矾(FeSO4?7H2O,式量为278)在高温下加热,充分反应后生成Fe2O3固体和SO2、SO3、水的混合气体,则生成Fe2O3的质量为32g;SO2为0.2mol.
实验室可用以下方法制备摩尔盐晶体[(NH4)2SO4•FeSO4•6H2O,式量为392].
(3)将4.88g铁屑(含Fe2O3)与25mL3mol/L H2SO4充分反应后,得到 FeSO4和H2SO4的混合溶液,稀释溶液至100mL,测得其pH=1.铁屑中Fe2O3的质量分数是0.66(或66%)(保留两位小数).
(4)向上述100mL溶液中加入与该溶液中FeSO4等物质的量的(NH4)2SO4晶体,待晶体完全溶解后蒸发掉部分水,冷却至t℃,析出摩尔盐晶体12.360g,剩余溶液的质量为82.560g.t℃时,计算(NH4)2SO4•FeSO4•6H2O的溶解度22.35g.(保留两位小数).
分析 (1)根据c=$\frac{1000ρw}{M}$计算出密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度;假设密度相同,混合后质量分数为40%,由于硫酸的质量分数越大,溶液中含有的硫酸的质量越大,所以混合后硫酸的质量分数大于40%;
(2)发生2FeSO4?7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2+SO3+7H2O,结合n=$\frac{m}{M}$及反应计算;
(3)先根据溶液的pH计算剩余硫酸的物质的量,再根据方程式计算氧化铁的质量,根据质量分数公式计算氧化铁的质量分数;
(4)根据原子守恒计算生成硫酸亚铁的物质的量及莫尔盐的物质的量,根据析出的晶体计算溶液中莫尔盐的质量,再根据$\frac{S}{100}=\frac{溶质}{溶剂}$计算其溶解度.
解答 解:(1)密度为1.4g/cm3、质量分数为50%的硫酸物质的量浓度为$\frac{1000×1.4×50%}{98}$mol/L≈7.14mol/L;假如50%的硫酸与30%的硫酸密度相同,则混合后硫酸的质量分数为40%,由于50%的硫酸的密度大于30%的硫酸,所以混合后溶液中硫酸的质量偏大,硫酸的质量分数大于40%,
故答案为:7.14 mol•L-1;>;
(2)n(FeSO4?7H2O)=$\frac{111.2g}{278g/mol}$=0.4mol,由2FeSO4?7H2O$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2+SO3+7H2O可知,生成Fe2O3的质量为0.4mol×$\frac{1}{2}$×160g/mol=32g,SO2为0.4mol×$\frac{1}{2}$=0.2mol,故答案为:32;0.2;
(3)根据题意知,稀释溶液至100mL,测得其pH=1,溶液中还有酸剩余,剩余的n(H2SO4)=0.1mol/L×$\frac{1}{2}$×0.1L=0.005mol,则参加反应的n(H2SO4)=0.025L×3mol/L-0.005mol=0.07mol,
设铁的物质的量是m,氧化铁的质量是n,
Fe+Fe2O3+3H2SO4=3FeSO4+3H2O
1mol 1mol 3mol
nmo nmol 3nmol
Fe+H2SO4=FeSO4+H2↑
1mol 1mol
(m-n)mol (m-n)mol
根据固体的质量和硫酸的物质的量可知,$\left\{\begin{array}{l}{56m+160n=4.88}\\{m-n+3n=0.07}\end{array}\right.$,解得n=0.02mol,m=0.03mol,
铁屑中Fe2O3的质量分数是$\frac{0.02mol×160g/mol}{4.88g}$×100%=0.66(或66%),
故答案为:0.66(或66%);
(4)根据以上结合原子守恒知,n(FeSO4)=n(Fe)+2n(Fe2O3)=(0.03+0.04)mol=0.07mol,根据莫尔盐的化学式知,n[(NH4)2SO4•FeSO4•6H2O]=n(FeSO4)=0.07mol,溶液中莫尔盐的质量为0.07mol×392g/mol-12.360g=15.08g,
设莫尔盐的溶解度为x,则$\frac{x}{100}$=$\frac{15.08g}{82.560g-15.08g}$,解得x=22.35g,
故答案为:22.35g.
点评 本题考查物质的量、质量分数等有关计算,为高频考点,注意(2)中铁不仅和稀硫酸反应还和铁离子反应,往往容易漏掉该反应而导致错误,为易错点,侧重分析与计算能力的综合考查,综合性较强,题目难度中等.

| 若电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | ${K}_{{a}_{1}}$=4.30×107 ${K}_{{a}_{2}}$=5.61×10-11 | Kh=1.77×10-5 |
常数Kh=$\frac{{K}_{w}}{{K}_{{a}_{2}}}$.下列说法正确的是.
| A. | 由数据可判断该溶液呈酸性 | |
| B. | c(NH4+)>c(HCO32-)>c(CO32-)>c(NH3•H2O) | |
| C. | c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| A. | 液氯、干冰均为纯净物 | |
| B. | NO2、CO、CO2均为酸性氧化物 | |
| C. | 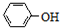 与 与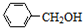 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
| A. | 0.2molAl与足量NaOH溶液反应,生成的H2分子数为0.3NA | |
| B. | 常温下,1LpH=1的盐酸溶液,由水电离的H+离子数目为0.1NA | |
| C. | 铅蓄电池中,当正极增加9.6g时,电路中通过的电子数目为0.2NA | |
| D. | 11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4 反应中,6 mol CuSO4能氧化白磷的分子数为1.1NA |
| A. | 属于羧基类的有2种 | |
| B. | 属于酯类的有3种 | |
| C. | 存在分子中含有六元环的同分异构体 | |
| D. | 分子中可含有两种不同的官能团 |
| A. | 可用铁作阳极材料 | |
| B. | 电解过程中阳极附近溶液的pH升高 | |
| C. | 阳极反应方程式为:2Cl--2e-═Cl2↑ | |
| D. | 1 mol二价镍全部转化为三价镍时,外电路中通过 了2 mol 电子 |
| A. | 受热时,碳酸氢钠比碳酸钠容易分解 | |
| B. | 碳酸氢钠俗名纯碱,碳酸钠俗名苏打 | |
| C. | 碳酸氢钠溶液显酸性,碳酸钠溶液显碱性 | |
| D. | 分别向等物质的量的两种白色粉末中加入等体积等浓度的稀盐酸,生成气体的速率,碳酸氢钠比碳酸钠慢 |
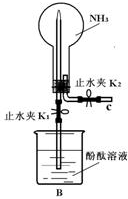 (1)甲同学用如图B装置做NH3喷泉实验,关闭K2,打开K1,用手捂热圆底烧瓶,一段时间后看到烧瓶内有红色喷泉现象.
(1)甲同学用如图B装置做NH3喷泉实验,关闭K2,打开K1,用手捂热圆底烧瓶,一段时间后看到烧瓶内有红色喷泉现象.