题目内容
【题目】H2C2O4(草酸)为二元弱酸,在水溶液中H2C2O4、HC2O4-和C2O42-物质的量分数与pH关系如图所示,下列说法不正确的是
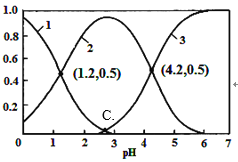
A. 由图可知,草酸的Ka=10-1.2
B. 0.1 mol·L—1NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H+)>c(OH-)
C. 向草酸溶液中滴加氢氧化钠溶液至pH为4.2时c(Na+)+c(H+)=3c(C2 O42-)+c(OH-)
D. 根据图中数据计算可得C点溶液pH为2.8
【答案】D
【解析】
由图线1为H2C2O4、2为HC2O4-、3为C2O42-。
A. 当pH为1.2时c(H+)=10-1.2 mol·L-1,c(HC2O4-)= c(H2C2O4)=0.5 mol·L-1,草酸的Ka=10-1.2,故A正确;
B. 0.1 mol·L-1NaHC2O4溶液显酸性c(H+)>c(OH-),HC2O4-会发生水解和电离c(Na+)>c(HC2O4-),因此c(Na+)>c(HC2O4-)>c(H+)>c(OH-),故B正确;
C. pH为4.2时,溶液中含有微粒为HC2O4-和C2O42-,且c(HC2O4-)= c(HC2O4-),根据电荷守恒 c(Na+)+c(H+)=c(HC2O4-)+2c(C2 O42-)+c(OH-),则有c(Na+)+c(H+)=3c(C2 O42-)+c(OH-),故C正确;
D.由于草酸为弱酸分两步电离,Ka1=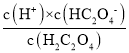 ,Ka2=
,Ka2=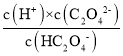 ,Ka1·Ka2=
,Ka1·Ka2=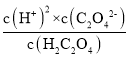 ,根据图中C点得到c(C2O42-)= c(H2C2O4),所以,Ka1
,根据图中C点得到c(C2O42-)= c(H2C2O4),所以,Ka1![]() Ka2=
Ka2=![]() ,当pH为1.2时c(H+)=10-1.2 mol·L-1,c(HC2O4-)= c(H2C2O4)=0.5 mol·L-1,草酸的Ka1=10-1.2。当pH为4.2时c(H+)=10-4.2 mol·L-1,c(HC2O4-)= c(C2O42-)=0.5 mol·L-1,草酸的Ka2=10-4.2;
,当pH为1.2时c(H+)=10-1.2 mol·L-1,c(HC2O4-)= c(H2C2O4)=0.5 mol·L-1,草酸的Ka1=10-1.2。当pH为4.2时c(H+)=10-4.2 mol·L-1,c(HC2O4-)= c(C2O42-)=0.5 mol·L-1,草酸的Ka2=10-4.2;![]() =
=![]() =
=![]() =
=![]() =10-2.7,C点溶液pH为2.7。故D错误。
=10-2.7,C点溶液pH为2.7。故D错误。
答案选D。

 阅读快车系列答案
阅读快车系列答案








