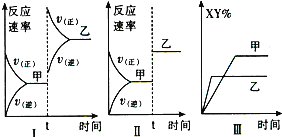
题目内容
【题目】7000C时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法中正确的是
A.反应在t1min内的平均速率为υ(CO2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.到t1min时,反应未达平衡状态
C.保持7000C不变,向平衡体系中再通入0.60molCO和0.30 molH2O,达到新平衡时与原平衡相比,CO转化率增大,H2的体积分数增大
D.温度升至8000C时,上述反应的平衡常数为0.64,则正反应为放热反应
【答案】D
【解析】
A、υ(CO2)=υ(CO)=![]() mol·L-1·min-1,A错误;
mol·L-1·min-1,A错误;
B、t1时,n(H2O)=0.2mol,与t2时相同,故已经达到平衡状态,B错误;
C、因为该反应为一体积不变的反应,再按比例通入反应物,相当于增大压强,平衡不移动,故转化率、体积分数均不变,C错误;
D、原平衡常数K=![]() =1,温度升高平衡常数减小,平衡逆向移动,逆向吸热,正反应方向放热,D正确。
=1,温度升高平衡常数减小,平衡逆向移动,逆向吸热,正反应方向放热,D正确。
答案选D。

【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品,工业上常用铝土矿(主要成分为Al2O3和少量的SiO2、Fe2O3杂质)生产铵明矾晶体NH4Al(SO4)212H2O,其工艺流程图如下:
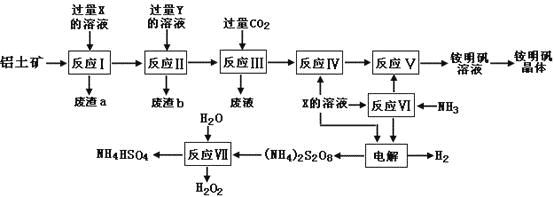
(1)废渣a、b 的成分分别是:_________、_____________。(写名称)
(2)流程图中X的化学式为:_______________。
(3)反应Ⅲ的离子方程式为:_________________________________________;从铵明矾溶液中获得铵明矾晶体的操作依次为(填操作名称)_________、冷却结晶、过滤洗涤。
(4)过硫酸铵[(NH4)2S2O8]在工业生产中有广泛的用途,可以作为氧化剂和漂白剂,广泛地用于蓄电池工业;还用作聚合的引发剂、纤维工业的脱浆剂。在上述的工艺流程中用惰性电极电解X与反应Ⅵ所得物质的混合溶液可以得到过硫酸铵。
写出阳极反应式:______________________________________________。
(5)反应Ⅶ的化学方程式为:________________________________________;
NH4HSO4溶液中离子浓度由大到小顺序为:_____________________________。
(6)向硫酸铝铵溶液中逐滴加入氢氧化钡溶液,不可能发生的反应是______(填选项字母)
A.4NH4Al(SO4)2+3Ba(OH)2=2(NH4)2SO4+3BaSO4↓+ Al2(SO4)3+2Al(OH)3↓ |
B.2NH4Al(SO4)2+4Ba(OH)2=(NH4)2SO4+3BaSO4↓+Ba(AlO2)2 |
C.2NH4Al(SO4)2+3Ba(OH)2=(NH4)2SO4+3BaSO4↓+2Al(OH)3↓ |
D.NH4Al(SO4)2+2Ba(OH)2=NH3·H2O+2BaSO4↓+ Al(OH)3↓ |
【题目】硫及其化合物有许多用途,相关物质的物理常数如表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | -85.5 | 115.2 | >600(分解) | -75.5 | 16.8 | 10.3 |
沸点/℃ | -60.3 | 444.6 | -10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态S原子电子占据最高能级的电子云轮廓图为___形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同其他分子的是__。
(3)图(a)为S8的结构,其硫原子的杂化轨道类型为___。
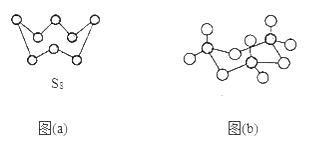
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为___形;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为__。