题目内容
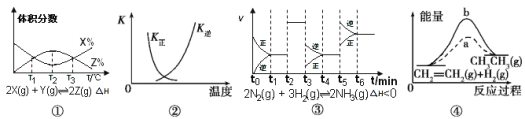
【题目】如图所示的电解池Ⅰ和Ⅱ中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d。符合上述实验结果的盐溶液是( )
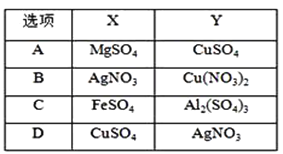

A.AB.BC.CD.D
【答案】D
【解析】
依据装置图分析电极名称a为阳极,b为阴极,c为阳极,d为阴极,结合电解原理,溶液中离子放电顺序分析判断电极反应,电极b和d上没有气体逸出,但质量均增大,说明阴极上溶液中金属离子在阴极析出金属单质,对选项分析判断。
根据装置图分析电极名称a为阳极,b为阴极,c为阳极,d为阴极,结合电解原理,溶液中离子放电顺序分析判断电极反应,电极b和d上没有气体逸出,但质量均增大,说明阴极上溶液中金属离子在阴极析出金属单质;
A.X为MgSO4,阴极电极反应为溶液中氢离子放电,无金属析出;Y为CuSO4,溶液中阴极上铜离子得到电子析出金属,故A错误;
B.X为AgNO3,阴极电极反应为溶液中银离子放电,电极反应为:Ag++e=Ag,Y为Pb(NO3)2,阴极上溶液中氢离子放电,无金属析出,故B错误;
C.X为FeSO4,阴极是溶液中氢离子得到电子生成氢气,无金属析出,Y为Al2(SO4)3,阴极上是氢离子放电无金属析出,故C错误;
D.X为CuSO4,阴极是溶液中铜离子析出,电极反应Cu2++2e=Cu,Y为AgNO3,阴极电极反应为溶液中银离子放电,电极反应为:Ag++e=Ag,依据电子守恒Cu2Ag,增重d>b,符合题意,故D正确。
答案选D。

【题目】7000C时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g);反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法中正确的是
A.反应在t1min内的平均速率为υ(CO2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.到t1min时,反应未达平衡状态
C.保持7000C不变,向平衡体系中再通入0.60molCO和0.30 molH2O,达到新平衡时与原平衡相比,CO转化率增大,H2的体积分数增大
D.温度升至8000C时,上述反应的平衡常数为0.64,则正反应为放热反应
【题目】前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如下表所示:
A | 2p能级电子半充满 |
B | 与A同周期,且原子核外有2个未成对电子 |
C | 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子 |
D | 其基态原子外围电子排布为msnmpn+2 |
E | 前四周期元素中,E元素基态原子未成对电子数最多 |
F | 基态F+各能级电子全充满 |
请根据以上情况,回答下列问题:
(1)E元素基态原子核外有__种能量不同的电子,电子排布式为__,画出F元素基态原子的价电子排布图___。
(2)与B相邻的同周期元素的第一电离能由大到小的顺序为___。(用元素符号表示)
(3)B、C、D三种元素的简单离子的半径由小到大的顺序为___(用离子符号表示)。