题目内容
已知298 K时,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,推测含1 mol HCl的稀溶液与含1 mol NH3的稀溶液反应放出的热量 ( )
| A.大于57.3 kJ | B.等于57.3 kJ |
| C.小于57.3 kJ | D.无法确定 |
C
解析试题分析:由于NH3·H2O是弱碱,一部分电离,电离要吸热,故1 mol NH3与1 mol HCl在稀溶液中反应时放出的热量小于57.3 kJ。
考点:本题考查了反应热的求算。

已知:H+(aq)+OH-(aq) =H2O(l); △H=-57.3 kJ·mol-1。现将一定量的稀盐酸、浓硫酸、稀醋酸分别和1L 1mol·L-1的NaOH溶液恰好完全反应,其反应热分别为△H1、△H2、△H3,,则△H1、△H2和△H3的大小关系为
| A.△H1=△H2 | B.△H2>△H1 |
| C.△H3>△H2 | D.△H1>△H3 |
下列有关热化学方程式的叙述中,正确的是 ( )
| A.含20.0g NaOH的稀溶液与足量的稀硫酸完全中和,放出28.7kJ的热量,则表示中[和热的热化学方程式为2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-114.8kJ/mol |
B.已知热化学方程式:SO2(g)+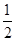 O2(g) O2(g) SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ SO3(g) △H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为196.64kJ |
| C.已知2H2(g)+O2(g)=2H2O(g); △H=-483.6kJ/mol,则H2的燃烧热为241.8kJ/mol |
| D.已知①S(s)+O2(g)=SO2(g); △H1②S(g)十O2(g)=SO2(g);△H2 则△H1>△H2 |
有关能量的判断或表示方法正确的是
| A.由:H+(aq) + OH-(aq) = H2O(l)△H = -57.3kJ/mol,可知:含0.5mol H2SO4的浓溶液与含1molNaOH的溶液混合,放出热量大于57.3 kJ |
| B.从C(石墨)= C(金刚石) △H =" +" 119kJ/mol,可知:金刚石比石墨更稳定 |
| C.等质量的硫蒸气和硫固体分别完全燃烧,后者放出热量更多 |
| D.没有单质参加的化合反应可能为氧化还原反应,也可能为放热反应 |
已知25℃、101kPa条件下:
①4Al(s)+3O2(g)=2Al2O3(s);△H=-2834.9kJ?mol-1
②4Al(s)+2O3(g)=2Al2O3(s);△H=-3119.1kJ?mol-1 由此得出的正确结论是
| A.等质量的O2比O3能量低,由O2变O3为吸热反应 |
| B.反应①可确定铝的燃烧热是708.7KJ |
| C.O3比O2稳定,由O2变O3为放热反应 |
| D.反应②可确定铝的燃烧热是779.78 kJ?mol-1 |
强酸与强碱在稀溶液中发生中和反应的热化学方程式为H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,向3份同体积0.2 mol ·L-1的NaOH溶液中分别加入适量的稀醋酸、浓硫酸、稀硝酸,恰好完全反应的热效应ΔH1、ΔH2、ΔH3的关系正确的是 ( )
| A.ΔH1>ΔH2>ΔH3 | B.ΔH2>ΔH3>ΔH1 |
| C.ΔH2>ΔH1>ΔH3 | D.ΔH1>ΔH3>ΔH2 |
下列热化学方程式正确的是(△H的绝对值均正确)( )
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0kJ·mol-1(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=+57.3kJ·mol-1(中和热) |
| C.S(s)+O2(g)=SO2(g)ΔH=-269.8kJ·mol-1(反应热) |
| D.2NO2=2NO+O2ΔH=+116.2kJ·mol-1(反应热) |
下列说法正确的是( )
| A.物质的化学变化都伴随着能量变化 |
| B.凡是吸热反应都需要加热 |
| C.任何反应中的能量变化都表现为热量变化 |
| D.拆开旧化学键吸收的能量一定大于形成新化学键放出的能量 |
已知1g氢气完全燃烧生成水蒸气时放出热量12lkJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为
| A.920kJ | B.557kJ | C.436kJ | D.188kJ |