题目内容
【题目】下列实验操作规范且能达到目的的是( )
目的 | 操作 | |
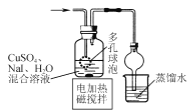
A | 配制480mL0.1mol/LCuSO4溶液 | 称取8.0g无水硫酸铜放在烧杯中,加入480mL的蒸馏水,用玻璃棒搅拌。 |
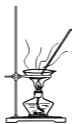
B | 除去氯化钠固体中少量的碳酸钙 | 加水稀盐酸、然后加热蒸干。 |
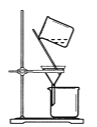
C | 提取碘水中的碘 | 用量筒量取一定量的碘水,倒入分液漏斗,注入四氯化碳,振荡、静置后分液。 |
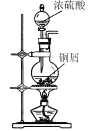
D | 除去N2气体中的少量O2 | 点燃,然后将混合气体通入澄清石灰水 |
A.AB.BC.CD.D
【答案】C
【解析】
A.配制一定物质的量浓度的溶液时用到的容量瓶的常见规格有:50mL,100mL,250mL,500mL,1000mL;因此为了获得480mL的溶液,就需要按照500mL的标准进行配制,根据公式:![]() 和
和![]() 计算可知,需要的无水硫酸铜的质量为8.0g,最终配制成500mL体积的溶液才可,A项错误;
计算可知,需要的无水硫酸铜的质量为8.0g,最终配制成500mL体积的溶液才可,A项错误;
B.碳酸钙属于难溶物,氯化钠属于易溶物,所以通过简单地溶解过滤再加热蒸干滤液即可;如果加入盐酸后,会引入新的杂质即易溶的氯化钙,B项错误;
C.提取碘水中的碘单质,采用萃取的方法即可,C项正确;
D.由于O2为少量,所以混合气体不支持燃烧;另外,O2属于助燃剂而非可燃物;可以采用将混合气体通过灼热铜单质或铁粉的方式除去混合气体中的氧气,D项错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目