题目内容
下表为元素周期表的一部分,请回答有关问题:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
(1)①和⑤的元素符号是 和 。
(2)表中最活泼的金属是 ,非金属性最强的元素是 。(填写元素符号)
(3)表中能形成两性氢氧化物的元素是 (填写元素符号),分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式: ,
。
(4)⑦和⑩元素形成单质的氧化性的强弱为 。(用化学符号表示)证明该结论的一个实验事实(用离子方程式表示) 。
(1) N Si(2) K F(3)Al 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
Al(OH)3+KOH=KAlO2+2H2O(4) Cl2>Br2 Cl2+2Brˉ=2Clˉ+Br2
解析:
本题考查对元素周期表及元素周期律的应用;(1)①位于周期表的第二周期第VA族,为氮元素,⑤位于第三周期第IVA族,为硅元素;(2)根据元素周期律,最活泼的金属在周期表的左下方,故图中⑨为最活泼的金属,位于第四周期第IA族,为钾元素;位于周期表右上方②在第二周期VIIA族,在为最活泼的非金属,为氟元素;(3)在表中④位于第三周期第IIIA族,为铝元素,其最高价氧化物的水化物为两性氢氧化物,⑥位于第三周期第VIA族,为硫元素,其最高价氧化物对应的水化物为H2SO4,与Al(OH)3反应的化学方程式为2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O;KOH与与Al(OH)3反应的化学方程式为Al(OH)3+KOH=KAlO2+2H2O;(4)⑦⑩同主族,根据元素周期律,同主族元素,从上到下,金属性增强,非金属性减弱,故⑩的非金属性大于⑦,即Cl2>Br2;如氯气可把溴从其化合物中置换出来:Cl2+2Brˉ=2Clˉ+Br2。









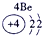
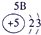
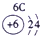
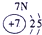
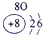
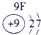
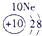
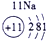





 表示的是
表示的是