题目内容
某溶液含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如下:
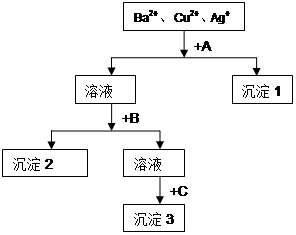
(1)所加试剂的化学式:A_________、B__________、C_________
(2)写出生成沉淀1的离子方程式:_________________________;
生成沉淀3的离子方程式:_____________________________。

(1)所加试剂的化学式:A_________、B__________、C_________
(2)写出生成沉淀1的离子方程式:_________________________;
生成沉淀3的离子方程式:_____________________________。
(7分)(1)A HCl、B Na2SO4或NaOH、C NaOH或Na2SO4
(2)Ag+ + Cl- = AgCl↓;Cu2+ + 2OH-= Cu(OH)2↓或 BaSO4 = Ba2+ + SO42-
(2)Ag+ + Cl- = AgCl↓;Cu2+ + 2OH-= Cu(OH)2↓或 BaSO4 = Ba2+ + SO42-
试题分析:根据三种阳离子的性质可知,三种阳离子只有和盐酸反应时,才能产生一种沉淀,所以A是盐酸,则沉淀1是氯化银。而沉淀Ba2+、Cu2+时,既可以先加入氢氧化钠,生成氢氧化铜沉淀,然后加入硫酸钠,生成硫酸钡沉淀;也可以先加入硫酸钠生成硫酸钡沉淀,然后再加入氢氧化钠,生成氢氧化铜沉淀。
点评:该题是中等难度试题的考查,也是高考中的常见题型,试题综合性强,侧重能力的培养,有利于培养学生分析问题、解决问题的能力。该类试题学生需要明确的是在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。

练习册系列答案
相关题目