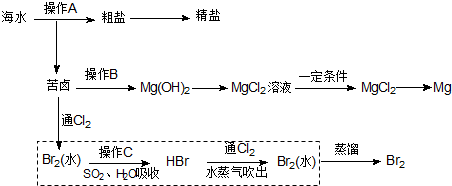
题目内容
5.A、B、C、D、E五种短周期元素从左到右原子序数依次增大(原子序数为5个连续的自然数),下列说法中正确的是( )①E元素的最高化合价为+7时,D元素的负化合价可为-2②A(OH)n为强碱时,B(OH)m也一定为强碱③HnDOm为强酸时,E的非金属性一定很强④HnCOm为强酸时,E的单质可能有强氧化性.
| A. | ①④ | B. | ①② | C. | ①③ | D. | ③④ |
分析 同一周期元素,元素的非金属性随着原子序数增大而增强、元素的金属性随着原子序数增大而减弱,
①E的原子序数最大,所以有可能是第ⅦA元素,则D就有可能是第ⅥA;
②元素的金属性越强,其最高价氧化物的水化物碱性越强;
③元素的非金属性越强,其最高价氧化物的水化物酸性越强;
④元素的非金属性越强,其最高价氧化物的水化物酸性越强,其单质的氧化性越强.
解答 解:同一周期元素,元素的非金属性随着原子序数增大而增强、元素的金属性随着原子序数增大而减弱,
①E的原子序数最大,所以有可能是第ⅦA元素,则D就有可能是第ⅥA,所以E元素的最高化合价为+7时,D元素的负化合价可为-2,故①正确;
②A、B为短周期元素,A的金属性大于B,如果A(OH)n为强碱时,B(OH)m不是强碱,故②错误;
③HnDOm为强酸,但不一定是最高价氧化物对应的水化物,即E的非金属性可能很强,也可能不是很强,故③错误;
④HnCOm为强酸时,C的非金属性较强,非金属性E>D>C,元素的非金属性越强,其单质的氧化性越强,所以E的单质可能有强氧化性,故④正确;
故选:A.
点评 本题考查了元素周期律,明确同一周期元素金属性、非金属性强弱变化规律是解本题关键,再结合元素非金属性强弱与其最高价氧化物的水化物酸性强弱之间的关系分析解答,题目难度不大.

练习册系列答案
相关题目
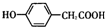
9.下列各组混合物,不论三者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是( )
| A. | 乙炔、苯、丙炔 | B. | 乙醇、甲酸、乙酸 | ||
| C. | 甲醛、乙酸、葡萄糖 | D. | 丙烯、乙烯、2-戊烯 |
20.(1)如图1是用KMnO4与浓盐酸反应制取适量氯气的简易装置.

装置B、C、D的作用分别是:B向上排气法收集氯气C安全作用,防止D中的液体倒吸进入集气管B中D吸收尾气,防止氯气扩散到空气中污染环境
(2)在实验室欲制取适量NO气体.
①图2中最适合完成该实验的简易装置是I(填序号);
②根据所选的装置完成下表(不需要的可不填):
③简单描述应观察到的实验现象:A中反应开始时,A中铜表面出现无色小气泡,反应速率逐渐加快,A管上部空间由无色逐渐变为浅棕红色,随反应的进行又逐渐变为无色,A中的液体由无色变为浅蓝色.B中B中的水面逐渐下降,B管中的水逐渐流入烧杯C中.

装置B、C、D的作用分别是:B向上排气法收集氯气C安全作用,防止D中的液体倒吸进入集气管B中D吸收尾气,防止氯气扩散到空气中污染环境
(2)在实验室欲制取适量NO气体.
①图2中最适合完成该实验的简易装置是I(填序号);
②根据所选的装置完成下表(不需要的可不填):
| 应加入的物质 | 所起的作用 | |
| A | ||
| B | ||
| C | ||
| D |
10.下列说法正确的是( )
| A. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 | |
| B. | 100mL 2mol/L的盐酸跟锌片反应,加入适量的氯化钠溶液,反应速率不变 | |
| C. | SO2的催化氧化是一个放热的反应,所以升高温度,反应的速率减慢 | |
| D. | 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态 |
17.下列离子方程式书写正确的是( )
| A. | 氯气与NaOH溶液反应:Cl2+OH-═Cl-+ClO-+H2O | |
| B. | 氢氧化铝与稀硫酸反应:OHˉ+H+═H2O | |
| C. | 铁粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化铝溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
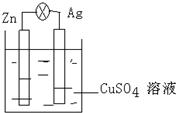 在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;银电极上的电极反应式是Cu2++2e-=Cu,银片上观察到的现象是有红色物质生成.
在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;银电极上的电极反应式是Cu2++2e-=Cu,银片上观察到的现象是有红色物质生成.
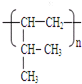
 ;
; .
.