题目内容
15.海水是巨大的资源宝库.下图是人类从海水资源获取某些重要化工原料的流程示意图.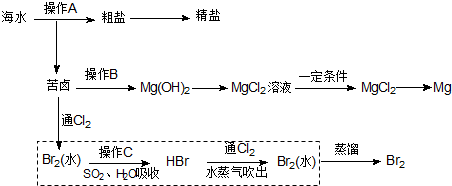
回答下列问题:
(1)操作A是蒸发结晶(填实验基本操作名称).
(2)操作B需加入下列试剂中的一种,最合适的是c(选填编号).
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是Cl2+2Br-=Br2+2Cl-,操作C所发生反应的离子方程式是Br2+SO2+2H2O=2Br-+SO42-+4H+.
(4)上图中虚线框内流程的主要作用是富集Br2;与之目的相同的流程在上图中还有几处,试指出其中一处海水蒸发结晶得到粗盐或苦卤→Mg(OH)2→MgCl2溶液.
(5)将MgCl2转化为Mg时获得的副产品是Cl2,用化学方程式表示该物质的某种用途2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
分析 (1)对于溶解度受温度影响大的物质可以通过降温结晶的方法得到晶体,对溶解度受温度影响小的物质可以通过蒸发结晶的方法得到晶体;
(2)根据工业制镁的原理从原料的成本以及性质来分析;
(3)氯气氧化溴离子得到单质溴;操作C是用二氧化硫吸收溴,生成溴化氢和硫酸;
(4)根据起初有溴最终也有溴,考虑物质的富集;根据流程图可知氯化钠、氯化镁的富集;
(5)根据电解熔融的氯化镁可冶炼金属镁,同时得到氯气;工业上以氯气和熟石灰(实际上用石灰乳)为原料制取漂白粉.
解答 解:(1)食盐的溶解度受温度变化影响较小,可以通过蒸发结晶的方法得到氯化钠,
故答案为:蒸发结晶;
(2)工业制镁:把海边的贝壳制成生石灰:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,在海水中加入生石灰:CaO+H2O═Ca(OH)2,在引入的海水中加入石灰乳,发生反应:MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2,这样原料的成本低,且能将镁离子全部沉淀下来,所以最合适的是石灰乳,
故选:c;
(3)氯气氧化溴离子得到单质溴,离子方程式为:Cl2+2Br-=Br2+2Cl-;操作C是用二氧化硫吸收溴,生成溴化氢和硫酸,反应的离子方程式为Br2+SO2+2H2O=2Br-+SO42-+4H+,
故答案为:Cl2+2Br-=Br2+2Cl-;Br2+SO2+2H2O=2Br-+SO42-+4H+;
(4)起初有溴最终也有溴,所以这一步为溴的富集;根据流程图可判断海水蒸发结晶得到粗盐;苦卤→Mg(OH)2→MgCl2溶液等均是氯化钠,氯化镁的富集,
故答案为:富集Br2;海水蒸发结晶得到粗盐或苦卤→Mg(OH)2→MgCl2溶液;
(5)电解熔融的氯化镁可以冶炼金属镁,同时得到氯气;工业上以氯气和熟石灰(实际上用石灰乳)为原料制取漂白粉,方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:Cl2;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
点评 该题侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力,属于中等难度的试题,试题综合性强.

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案| A. | 氰化钾(KCN) | B. | 碳酸氢钾(KHCO3) | C. | 乙炔(C2H2) | D. | 碳化硅(SiC) |
| A | B | C | D | E |
| ①属于烃类物质; ②球棍模型为: 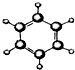 | 1例模型为: ②能与水在一定条件下反应生成C. | ①是烃的含氧衍生物; ②可用于厨房烹调,制作饮品. | ①相对分子质量比C少2; ②能由C氧化而成. | ①淀粉水解的最终产物; ②能发酵生成C. |
(1)A与氢气发生反应所得产物的结构简式为
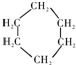 ;能与新制Cu(OH)2反应产生红色沉淀的物质有D(填序号).E的结构简式为CH2OHCHOHCHOHCHOHCHOHCHO.
;能与新制Cu(OH)2反应产生红色沉淀的物质有D(填序号).E的结构简式为CH2OHCHOHCHOHCHOHCHOHCHO.(2)B与氢气发生加成反应后生成F,F的同系物中,当碳原子数为4时开始出现同分异构现象,该有机物含支链的同分异构体的结构简式为(CH3)2CHCH3.
(3)写出下列转化反应的化学方程式,并标明反应类型:
①A与浓硫酸、浓硝酸混合加热:
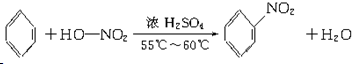 ,取代反应;
,取代反应;②由B合成高分子化合物:
 ,加聚反应;
,加聚反应;③C→D:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O.
(4)等物质的量的A、B、C、D、E五种物质完全燃烧,消耗氧气的体积(相同条件)大小顺序为苯>葡萄糖>乙烯=乙醇>乙醛.(填物质名称)
| A. | 反应物化学性质 | B. | 温度 | C. | 反应物浓度 | D. | 催化剂 |
| A. | ①②④ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
| A. | 在原电池中,物质在负极发生氧化反应 | |
| B. | 在原电池中,电子由负极流向正极 | |
| C. | 在电解池中,物质在阳极发生还原反应 | |
| D. | 在电解池中,与电源负极相连的电极是阴极 |
| A. | Na2S溶液中加入少量FeCl3溶液:2Fe3++S2-→2Fe2++S↓ | |
| B. | 向NaOH溶液中滴加碳酸氢钙溶液至OH-恰好完全反应:Ca2++2OH-+2HCO3-→CaCO3↓+2H2O+CO32- | |
| C. | 向NaClO溶液中通入少量SO2气体:ClO-+SO2+H2O→SO42-+Cl-+2H+ | |
| D. | Na2CO3溶液中滴入少量邻羟基苯甲酸溶液: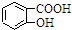 +CO32-→ +CO32-→ +HCO3- +HCO3- |
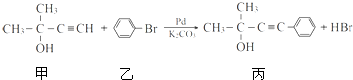
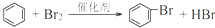 .
.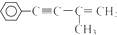 的反应条件是浓硫酸、加热.
的反应条件是浓硫酸、加热.