题目内容
8.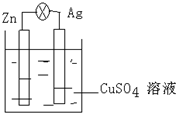 在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;银电极上的电极反应式是Cu2++2e-=Cu,银片上观察到的现象是有红色物质生成.
在银锌原电池中,以硫酸铜为电解质溶液,锌为负极,电极上发生的是氧化反应(“氧化”或“还原”),电极反应式为Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;银电极上的电极反应式是Cu2++2e-=Cu,银片上观察到的现象是有红色物质生成.
分析 银、锌、硫酸铜溶液构成原电池中,易失电子的锌作负极,银作正极,负极上发生失电子的氧化反应,正极上得电子发生还原反应,根据电子守恒结合电极反应来计算回答.
解答 解:银、锌、硫酸铜溶液构成原电池中,易失电子的锌作负极,负极上发生失电子的氧化反应:Zn-2e-=Zn2+,锌片上观察到的现象为锌片溶解;银作正极,正极上得电子发生还原反应,即Cu2+得电子析出金属铜,反应式为 Cu2++2e-=Cu,现象是有红色物质生成;
故答案为:负;氧化;Zn-2e-=Zn2+;锌片溶解; Cu2++2e-=Cu;有红色物质生成.
点评 本题考查学生原电池的工作原理、电极反应式的书写、电子守恒的计算等知识,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列说法中正确的是( )
| A. | NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构 | |
| B. | P4和CH4都是正四面体分子且键角都为109°28ˊ | |
| C. | NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 | |
| D. | 单质的晶体中一定不存在的微粒是阳离子 |
16.下列叙述正确的是( )
| A. | NaHCO3与石灰水反应当n(NaHCO3):n[Ca(OH)2]=2:1时HCO3-完全转化为CaCO3 | |
| B. | CO2通入石灰水中,当n(CO2):n[Ca(OH)2]=1:1时,能得到澄清溶液 | |
| C. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=1:1时,铝元素以AlO2-形式存在 | |
| D. | Cl2通入含2mol FeI2的溶液中,当n(Fe2+):n(I2)=1:1时,通入的Cl2为2mol |
13.某羧酸衍生物A,其分子式为C6H12O2,实验表明A和氢氧化钠溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化和加热的条件下氧化为E,其中D、E都不能发生银镜反应.由此判断A的可能的结构有( )
| A. | 6种 | B. | 4种 | C. | 2种 | D. | 1种 |
20.下列实验装置中正确的是( )
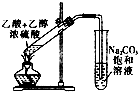

| A. | 实验室用液溴、苯和铁制备溴苯时必须加热 | |
| B. | 实验室可用如图所示装置进行酯化实验 | |
| C. | 如果甲烷中混有少量乙烯,可以通过盛有酸性KMnO4溶液进行除杂 | |
| D. | 将加热后的铜丝多次插入乙醇中,乙醇中可以闻到刺激性气味 |
17.下列选项中能发生反应,且甲组为取代反应,乙组为加成反应的是( )
| 甲 | 乙 | |
| A | 苯与溴水 | 乙烯与水制乙醇(催化剂) |
| B | 油脂水解(催化剂、加热) | 苯与氢气(催化剂、加热) |
| C | 油脂水解 | 乙酸和乙醇的酯化反应(催化剂、加热) |
| D | 乙烯与溴的四氯化碳溶液 | 甲烷与氯气(光照) |
| A. | A | B. | B | C. | C | D. | D |

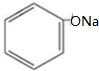 +CO2+H2O→
+CO2+H2O→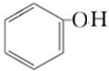 +NaHCO3.
+NaHCO3.