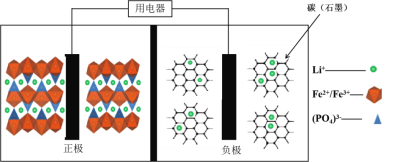
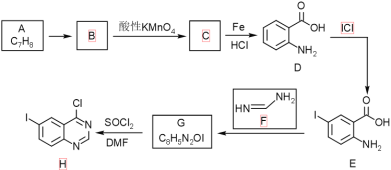
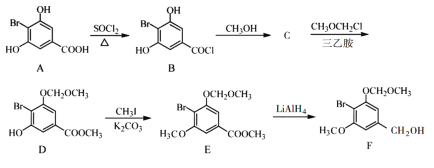
题目内容
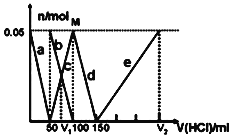
【题目】合成氨工业对国民经济和社会发展具有重要的意义,对密闭容器中的反应:N2(g)+3H2(g) ![]() 2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
2NH3(g) △H<0。400℃、30MPa下n(NH3)和n(H2)随时间变化的关系如图,下列叙述错误的是( )
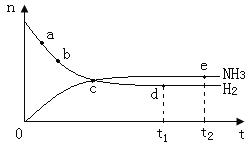
A.点a的正反应速率比b点的大
B.点c处反应还未达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,500℃下反应至t1时刻,n(H2)比右图中d点的值大
【答案】C
【解析】
在N2(g)+3H2(g)2NH3(g)反应中,随着反应的进行,反应物的物质的量逐渐减少,生成物的物质的量逐渐增多,当达到平衡状态时,正逆反应速率相等,反应物、生成物的物质的量不再改变,曲线为水平直线,a、b、c点均未达到平衡,d、e点为平衡状态,升高温度平衡逆向移动,据此答题。
A. 反应物起始浓度最大,正反应速率最大,随着反应进行,反应物浓度降低,正反应速率降低,点a的正反应速率比b点大,A项正确;
B. 当n(NH3)和n(H2)不随时间变化而变化时,可逆反应达到平衡状态,由图可知,点c未达平衡状态,B项正确;
C. 点d和点e处,n(NH3)和n(H2)不再发生变化,则已经达到平衡状态,即点d(t1时刻)和点e(t2时刻)处n(N2)一样,C项错误;
D. 由于该反应△H<0,反应放热,400℃到500℃,温度升高,化学平衡向逆反应方向移动,即500℃时,n(H2)比图中d点的值大,D项正确;
答案选C。

【题目】某学校课外活动小组仅有一大一小两试管和氢氧化钠溶液。甲、乙两个同学找来铝制废牙膏皮,各自设计了一套装置如下图,制取并收集一试管氢气。
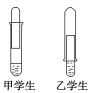
(1)哪个学生设计的装置比较合理?____(填“甲”或“乙”),另一设计装置不合理的原因____________
(2)用比较合理的装置制取氢气,要使氢气充满收集氢气的试管,应该采取的措施是____。
(3)还可以用哪些常见物品和试剂代替废牙膏皮和氢氧化钠溶液完成实验?_____________
(4)测定H2和空气混合气体的爆炸范围实验如下所述。取10支大试管,依次盛水90%(体积分数)、80%……再用排水集气法收集H2,而后分别把试管口移近酒精灯火焰,实验结果如下:
H2体积分数/% | 90 | 80 | 70 | 60~20 | 10 | 5 |
空气体积分数/% | 10 | 20 | 30 | 40~80 | 90 | 95 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱爆炸 | 强爆炸 | 弱爆炸 | 不燃烧 不爆炸 |
由上述实验结果评价:用向下排空气法收集H2,保持试管倒置移近火焰,如果只发出轻微的“噗声”,表示收集的H2已纯净的说法的真正涵义:________________________。