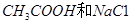题目内容
针对0.1 mol·L-1的醋酸溶液,下列分析判断正确的是( )
| A.升高温度,溶液的pH会增大 |
| B.加入少量固体NaOH,溶液中c(CH3COO-)+c(OH-)>c(Na+)+c(H+) |
| C.加入少量0.2 mol·L-1的硫酸溶液,水电离产生的c(H+)减小 |
| D.与0.1 mol·L-1的NaOH溶液等体积混合后,溶液中c(CH3COO-)=c(Na+) |
C
升高温度,醋酸的电离程度增大,氢离子的浓度增大,溶液的pH减小,A错误;B选项不符合电荷守恒,错误;加入少量0.2 mol·L-1的硫酸溶液,氢离子的浓度增大,水的电离受到抑制,C正确;与0.1 mol·L-1的NaOH溶液等体积混合后,生成强碱弱酸盐,溶液呈碱性,根据电荷守恒知,溶液中c(CH3COO-)<c(Na+),D错误。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
 )
) )>c(HC
)>c(HC )
)
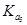 >
>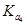 >
>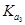
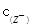 /
/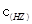 ·
·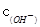 的比值变小,若加少量盐酸,则比值变大
的比值变小,若加少量盐酸,则比值变大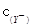 <
<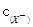
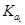 >
>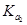 >
> 是弱电解质的是
是弱电解质的是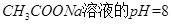
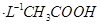 溶液的pH=2.8
溶液的pH=2.8 溶液与稀盐酸反应生成
溶液与稀盐酸反应生成