题目内容
下列叙述正确的是
| A.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| B.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
| C.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| D.常温下KSP(AgCl)=1.5×10-4,此时将足量氯化银固体分别投入相同体积的①蒸馏水②0.1mol/L盐酸③0.1 mol/L氯化镁溶液④0.1 mol/L硝酸银溶液中,则溶液中Ag+浓度:①>④=②>③ |
A
试题分析:A、浓度均为0.1 mol·L-1的4种溶液中,NaOH溶液的碱性最强,pH最大,NaHSO4溶液的酸性最强,pH最小,Na2CO3水解使溶液显碱性,(NH4)2SO4水解使溶液显酸性,所以pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4,正确;B、若H2A是强酸,则NaHA溶液的pH<7, 若H2A是弱酸,则NaHA溶液的pH不确定,须看HA-的水解程度与电离程度的大小比较,所以pH<7不能判断H2A是强酸,错误;C、醋酸为弱酸,稀释会促进醋酸的电离,所以体积扩大10倍,c(H+)降低不到原来的1/10,pH增加不到1,错误;D、KSP(AgCl)=c(Cl-)c(Ag+),①中c2(Ag+)=1.5×10-4,②中c(Cl-)=0.1mol/L,则c(Ag+)=1.5×10-4/0.1 =1.5×10-3 mol/L,③中c(Cl-)="0.2," c(Ag+)=1.5×10-4/0.2 =7.5×10-4 mol/L, ④中c(Ag+)="0.1" mol/L,所以溶液中Ag+浓度的大小顺序为④>①>②>③,错误,答案选A。

练习册系列答案
相关题目
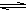 CH3COO- + H3O+
CH3COO- + H3O+