题目内容
【题目】储氢材料是科学研究的热点之一。
(1)无机盐储氢原理:NaHCO3(s)+H2(g) ![]() HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
HCOONa+H2O,HCOONa中的化学键类型有____;在NaHCO3中,C、H、O的电负性由大到小的顺序为_________。
(2)近年来,研究人员发现苯和甲苯都是比较理想的有机液体储氢材料。C6H6(苯)+3H2![]() C6H12(环已烷);C6H5-CH3(甲苯)+3H2
C6H12(环已烷);C6H5-CH3(甲苯)+3H2![]() C6H11-CH3(甲基环己烷)
C6H11-CH3(甲基环己烷)
①甲苯分子中碳原子的杂化类型是__________;
②能体现环已烷分子的空间构型的键线式为____________。
(3)金属钛具有较强的储氢能力。钛的储氢反应为Ti+H2![]() TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
TiH2。工业上,冶炼钛的原理是钛的氧化物在高温下与焦炭、氯气反应生成TiCl4和CO。
①CO能形成Ni(CO)4,沸点为42.2℃,Ni(CO)4的晶体类型为______________,CO与N2互为等电子体,标准状况下,VL CO分子形成Ni(CO)4中含o键数目为________。
②基态钛原子中电子能量最高的电子排布图为_________
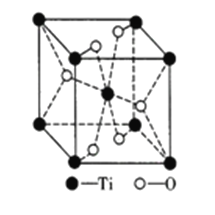
③钛的氧化物晶胞如图所示。该钛的氧化物晶体的化学式为_______已知钛的氧化物晶胞参数为a·10-3μm,NA代表阿伏加德罗常数的值,则该晶体的密度为_______g·cm-3。
【答案】 离子键、极性共价键 O>C>H sp2、sp3 ![]() 分子晶体 VNA/11.2
分子晶体 VNA/11.2 ![]() TiO2
TiO2 ![]()
【解析】(1)HCOONa为盐,存在离子键;氢、碳、氧之间形成极性共价键;正确答案:离子键、极性共价键;同周期元素从左到右元素的电负性逐渐增大,同一主族从上到下越来越小,所以,H最小;正确答案:O>C>H;
(2)①苯环上的碳所处环境都一样且均共平面,属于sp2杂化,而甲苯中甲基中碳原子与苯环上碳不一样,属于sp3 杂化;正确答案:sp2、sp3 ;
②环乙烷分子为空间构型,而非平面构型,正确答案:![]() ;
;
(3)①分子晶体的熔沸点较低;正确答案:分子晶体;因为CO与N2互为等电子体,故每个CO分子含有1个![]() 键,Ni与CO形成4个配位键,属于
键,Ni与CO形成4个配位键,属于![]() 键,故1mol Ni(CO)4含有8mol
键,故1mol Ni(CO)4含有8mol ![]() 键,所以标准状况下,VL CO分子形成Ni(CO)4中含o键数目为(V
键,所以标准状况下,VL CO分子形成Ni(CO)4中含o键数目为(V![]() NA/22.4)
NA/22.4)![]() 8
8![]() = VNA/11.2;正确答案:VNA/11.2;
= VNA/11.2;正确答案:VNA/11.2;
②钛元素的原子序数为22,基态原子的电子排布1s22s22p63S23p63d24s2,且因为钻穿效应导致4s电子离原子核更近,能量更低,故3d轨道电子能量最高,所以基态钛原子中电子能量最高的电子排布图为![]() ;正确答案:
;正确答案:![]() ;
;
③因为单位晶胞中含有2个Ti2+,4个O2-,故组成比为1:2,所以该晶体化学式为TiO2;
TiO2的分子量为80,一个晶胞中含有2个TiO2,根据密度计算公式:ρ=m/V,带入数据计算:
![]() =(2
=(2![]() 80)/NA
80)/NA![]() a
a![]() 10-7)3=
10-7)3=![]() ,正确答案:
,正确答案:![]() ;
;

【题目】完成下列填空:某化学小组拟采用如下装置(夹持和加热仪器等已略去)来电解饱和食盐水,并用电解产生的 H2 还原 CuO 粉末来测定 Cu 的相对原子质量,同时验证氯气的氧化性。

完成下列填空:
(1) 写出甲装置中反应的化学方程式______________________________。
(2) 为完成上述实验,正确的连接顺序为 A 连______,B连_____(填写接口字母)。
(3)乙装置中 a 试剂可以是_______________。
(4) 测定 Cu 的相对原子质量。将w g CuO 置于硬质玻璃管中,按以下两个方案测得的数据计算 Cu 的相对原子质量
方案 1 | 方案 2 | |
U 型管+固体 | 硬质玻璃管+固体 | |
反应前的总质量/g | a | c |
反应后的总质量/g | b | d |
你认为较佳方案是_____________,另一个方案得到的 Cu 的相对原子质量会_______(选填“偏低”、或“偏高”)
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为_______。元素⑩在周期表中的位置为________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________,碱性最强的化合物的电子式是_______,⑤的单质在该化合物的水溶液中反应的离子方程式为_____。
(3)用电子式表示元素④与⑥的化合物的形成过程___________________,该化合物属于_____(填“共价”或“离子”)化合物。
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_____(用化学式表示)。
(5)元素①的最简单氢化物的结构式为________,与该化合物相差一个CH2的同系物可用于形成燃料电池,写出电解质溶液呈碱性时负极的电极反应式_______________。