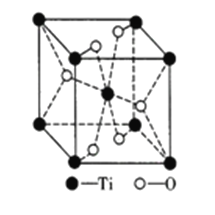
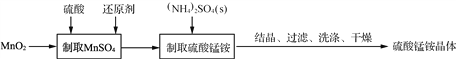
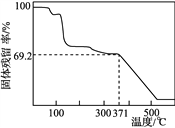
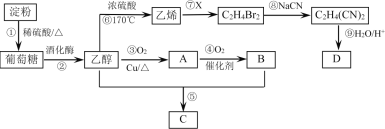
题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
主族周期 | I A | IIA | IIIA | IVA | VA | VIA | VIIA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为_______。元素⑩在周期表中的位置为________________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_________,碱性最强的化合物的电子式是_______,⑤的单质在该化合物的水溶液中反应的离子方程式为_____。
(3)用电子式表示元素④与⑥的化合物的形成过程___________________,该化合物属于_____(填“共价”或“离子”)化合物。
(4)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是_____(用化学式表示)。
(5)元素①的最简单氢化物的结构式为________,与该化合物相差一个CH2的同系物可用于形成燃料电池,写出电解质溶液呈碱性时负极的电极反应式_______________。
【答案】![]() 第四周期第ⅦA族HClO4
第四周期第ⅦA族HClO4![]() 2Al+2OH-+2H2O=2AlO2-+3H2↑
2Al+2OH-+2H2O=2AlO2-+3H2↑![]() 离子S2->Cl->O2-
离子S2->Cl->O2-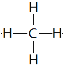 C2H6-14e-+18OH-=2CO32-+12H2O
C2H6-14e-+18OH-=2CO32-+12H2O
【解析】
由元素在周期表中位置,知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,则
(1)稀有气体Ar原子最外层有8个电子,为稳定结构,化学性质最不活泼,原子结构示意图为![]() ,元素⑩为Br元素,处于周期表中第四周期第ⅦA族;
,元素⑩为Br元素,处于周期表中第四周期第ⅦA族;
(2)上述元素中Cl非金属性最强,其最高价含氧酸HClO4的酸性越强;上述元素中,K的金属性最强,故KOH的碱性最强,KOH的电子式为![]() ,单质铝与氢氧化钾溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
,单质铝与氢氧化钾溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)④与⑥形成的化合物为Na2S,由钠离子与硫离子构成,形成的是离子化合物,用Na原子、S原子电子式表示其形成过程为![]() ;
;
(4)③、⑥、⑦三种元素形成的离子分别是:O2-、S2-、Cl-,氧离子电子层数为2,后两者为3层,由于S的原子序数小于Cl,故离子半径由大到小的顺序是S2->Cl->O2-;
(5)元素①的最简单氢化物是甲烷,结构式为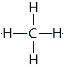 ,与该化合物相差一个CH2的同系物是乙烷,乙烷可用于形成燃料电池,其中乙烷发生失去电子的氧化反应,在负极通入,所以电解质溶液呈碱性时负极的电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O。
,与该化合物相差一个CH2的同系物是乙烷,乙烷可用于形成燃料电池,其中乙烷发生失去电子的氧化反应,在负极通入,所以电解质溶液呈碱性时负极的电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案【题目】利用如图所示装置测定中和热的实验步骤如下:
①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液温度。
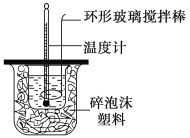
回答下列问题:
(1)倒入NaOH溶液的正确操作是________(填序号)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使盐酸与NaOH溶液混合均匀的正确操作是________(填序号)。
A.用温度计小心搅拌
B.揭开泡沫塑料板用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地上下搅动
(3)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为__________________。
(4)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________(结果保留一位小数)。
(5)________(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是____________________________________________________。