题目内容
【题目】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g)![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 05535 | 1858 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______(填“低温”、“高温”或“任何温度”),ΔH1____ΔH3(填“>”、“<”或“=”)。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于___________________________________________________________________。
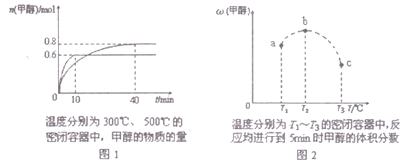
(3)在常压、Cat.1催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。

注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示CO2的选择性
① 下列说法不正确的是__________。
A.反应适宜温度为300℃
B.工业生产通常在负压条件下进行甲醇水蒸气重整
C.己知Cat.2催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线。________________

(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是:___________。
【答案】高温>甲醇转化率高;产物中氢气含量高,一氧化碳含量低ABC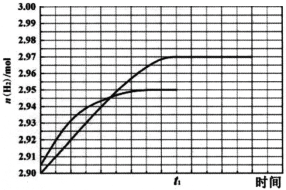 CO2+2H++2e-==HCOOH
CO2+2H++2e-==HCOOH
【解析】
(1)当温度增大时,反应Ⅱ的化学平衡常数K2也增大,说明温度升高有利于反应Ⅱ正向进行,则反应Ⅱ为吸热反应;反应Ⅱ为气体分子数增多的反应,随着反应进行,体系混乱度增大,则反应Ⅱ的熵增,所以反应Ⅱ自发进行的条件是高温,反应Ⅱ可由反应Ⅰ减去反应Ⅲ得到,根据盖斯定律,△H2=△H1-△H3,由于△H2>0,所以△H1>△H3。 (2)比较反应Ⅱ与反应Ⅰ,反应Ⅰ和反应Ⅱ消耗相同的甲醇时,反应Ⅰ产生的氢气更多,同时产生更少的一氧化碳,因此反应Ⅱ的先进之处在于甲醇转化率高,产物中氢气含量高,一氧化碳含量低。 (3). ①A.反应温度在260℃和300℃之间时,甲醇的转化率几乎不发生变化,二氧化碳的选择性降低,一氧化碳的选择性提高,所以反应适合的温度不是300℃,故错误;B.负压相对于大气压降低,相当于大气压对体系加压,有利于反应向压强降低的方向进行,即有利于反应逆向进行,会导致氢气的产率降低,故错误; C.催化剂不能改变化学平衡状态,对于某温度下的平衡转化率,催化剂不能改变该温度下的反应的平衡状态,只能缩短达到平衡的的时间,故错误;D.260℃之前,随着温度升高,甲醇的转化率增大,260之后,随着温度升高,甲醇的转化率几乎不变,说明260℃之前催化剂起着一定的性能,260℃之后催化性能降低,对于260℃之前的过程,添加氧化钙的复合催化剂可提高氢气产率,故正确。故选ABC;②温度升高,化学反应速率加快,达到化学平衡的时间缩短,反应为放热反应,温度升高,不利于化学平衡正向移动,所以平衡时氢气的产量降低,图像应为: 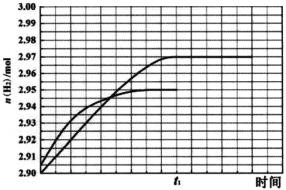
(4)二氧化碳可以在酸性水溶液中电解生成甲酸,碳的化合价降低,二氧化碳发生还原反应,所以电极反应为: CO2+2H++2e-==HCOOH。

 名校课堂系列答案
名校课堂系列答案【题目】甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为: CO(g)+ 2H2(g)![]() CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
(1)已知:![]() △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1
![]() △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为:
_______________________________________________;
(2)在容积为1L的恒容容器中,分别研究在230℃、250℃、 270℃三种温度下合成甲醇的规律。右图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。请回答:

①在上述三种温度中,曲线Z对应的温度是__________
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+ 2H2(g) ![]() CH3OH(g)的平衡常数K=_____________________。
CH3OH(g)的平衡常数K=_____________________。
(3)在某温度下,将一定量的CO和H2投入10L的密闭容器中,5min时达到平衡,各物质的物质的浓度(molL-1)变化如下表所示:
0min | 5min | 10min | |
CO | 0.1 | 0.05 | |
H2 | 0.2 | 0.2 | |
CH3OH | 0 | 0.04 | 0.05 |
若5min~10min只改变了某一条件,所改变的条件是_________________________;且该条件所改变的量是_______________。
【题目】NH3是一种重要的化工原料,在生产、生活中用途广泛。
(1)已知:
共价键 | 键能/ kJ·mol-1 |
H―H | 436 |
N≡N | 946 |
N―H | 391 |
注:拆开气态物质中1 mol某种共价键需要吸收的能量,就是该共价键的键能。
N2 (g)+3 H2 (g)![]() 2 NH3 (g) H =____kJ·mol-1
2 NH3 (g) H =____kJ·mol-1
(2)一定温度下,向恒容的密闭容器中充入N2和H2发生反应:N2 +3H2 ![]() 2NH3,测得各组分浓度随时间变化如图1所示。
2NH3,测得各组分浓度随时间变化如图1所示。
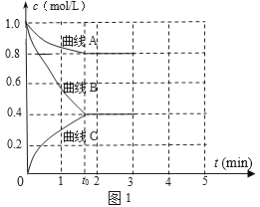
①表示c(N2)的曲线是__(填“曲线A”、“曲线B”或“曲线C”)。
②0~t0时用H2表示反应速率v(H2)____mol·L-1·min-1。
③下列能说明该反应达到平衡的是____。
a.混合气体的压强不再变化
b.2c(H2)= 3c(NH3)
c.混合气体的质量不再变化
d.NH3的体积分数不再变化
(3)潜艇中使用的液氨-液氧燃料电池工作原理如图2所示:
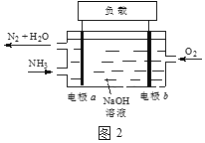
①电极b名称是____。
②电解质溶液中OH-离子向____移动(填“电极a”或“电极b”)。
③电极a的电极反应式为____。
(4)可通过NH3与NaClO反应来制得火箭燃料肼(N2H4)。该反应的化学反应方程式是____。
【题目】一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有__________(填“氧化性”或“还原性”)。
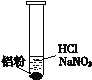
(2)该同学若H+大量存在,则NO3-就不能大量存在。设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
①盐酸溶解Al2O3薄膜的离子方程式是_______________________________。
②根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实验 | 内容 | 现象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
a.浅棕色气体是____________。
b.实验1的目的是_______________________________。
c.实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
______Al +______NO3-+_____ _ ==______Al 3++______NO+______ ,_______
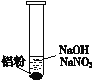
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。重新设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
①刺激性气味的气体是____________。
②产生该气体的离子方程式是____________________________________。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是_________________________________。
(5)实验结果证实:NO3-在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。试题中的无色溶液一定能大量存在的是_______________。
【题目】下列各组物质除杂和分离方法正确的是( )
被提纯物质 | 除杂试剂 | 分离方法 | |
A | 苯(苯甲酸) | 生石灰 | 蒸馏 |
B | 乙酸乙酯(乙酸) | 氢氧化钠溶液 | 分液 |
C | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 苯(苯酚) | 浓溴水 | 过滤 |
A.AB.BC.CD.D