题目内容
7.某亚硫酸钠试剂已被部分氧化.为了确定它的纯度,要进行如下实验:①称取样品w1g;②将样品溶解;③在溶液中加入稍过量的盐酸酸化的BaCl2溶液;④将沉淀过滤,洗涤、干燥后称重,质量为w2g.试回答:
(1)BaCl2溶液要用盐酸酸化的原因是为了防止BaSO3沉淀的产生,而引起误差;
(2)BaCl2溶液要稍过量的原因是使SO42-沉淀完全;
(3)判断沉淀是否完全的方法是向③的上层清液中加入氯化钡溶液,若无沉淀产生,则沉淀完全;
(4)判断沉淀是否洗尽的方法是取最后一次洗涤液少许,滴加AgNO3溶液,如无沉淀,则沉淀已洗净,反之则未洗净;
(5)Na2SO3样品纯度的计算式是$\frac{233w{\;}_{1}-142w{\;}_{2}}{233w{\;}_{1}}$×100%.
分析 (1)根据亚硫酸根也可以与钡离子生成亚硫酸钡沉淀分析;
(2)根据确定它的纯度,则要使氧化成的SO42-沉淀完全;
(3)如果沉淀完全,则在滤液中不存在着硫酸根离子,那么若要验证沉淀是否完全,则就检验滤液中是否含有硫酸根离子,可以向滤液中加入氯化钡,看是否能够产生沉淀;
(4)根据检验最后一次洗涤液是否还还有杂质离子来判断是否洗尽;
(5)根据最终沉淀硫酸钡的质量计算已被氧化成硫酸钠的质量,再根据总质量求出Na2SO3的质量结合质量分数=$\frac{m(Na{\;}_{2}SO{\;}_{3})}{m(总)}$×100%计算.
解答 解:(1)因为亚硫酸根也可以与钡离子生成亚硫酸钡沉淀,所以测定亚硫酸钠试剂已被部分氧化时要保证亚硫酸根不沉淀,则选用的氯化钡必须在酸性条件下即BaCl2溶液要用盐酸酸化,故答案为:为了防止BaSO3沉淀的产生,而引起误差;
(2)加入过量的氯化钡为了将溶液中的硫酸根离子全部转化为沉淀,以使结果更准确,故答案为:使SO42-沉淀完全;
(3)如果沉淀完全,则在滤液中不存在着硫酸根离子,那么若要验证沉淀是否完全,则就检验滤液中是否含有硫酸根离子,可以向滤液中加入氯化钡,看是否能够产生沉淀,如果产生了沉淀,说明沉淀不完全,如果没有白色沉淀产生则说明沉淀完全,故答案为:向③的上层清液中加入氯化钡溶液,若无沉淀产生,则沉淀完全;
(4)因为加入的是过量的盐酸酸化的BaCl2溶液,所以沉淀表面会含有少量的氯离子,则取最后一次洗涤液少许,滴加AgNO3溶液,如无沉淀,则沉淀已洗净,反之则未洗净,故答案为:取最后一次洗涤液少许,滴加AgNO3溶液,如无沉淀,则沉淀已洗净,反之则未洗净;
(5)根据题意可知发生的反应为硫酸钠和氯化钡的反应,同时生成硫酸钡的质量为W2g,设硫酸钠的质量为x,则
BaCl2+Na2SO4═2NaCl+BaSO4↓
142 233
x W2g
$\frac{142}{233}$=$\frac{x}{w{\;}_{2}}$
解得:x=$\frac{142w{\;}_{2}}{233}$g,
所以亚硫酸钠的质量分数可以表示为:$\frac{w{\;}_{1}-\frac{142{w}_{2}}{233}}{w{\;}_{1}}$×100%=$\frac{233w{\;}_{1}-142w{\;}_{2}}{233w{\;}_{1}}$×100%;
故答案为:$\frac{233w{\;}_{1}-142w{\;}_{2}}{233w{\;}_{1}}$×100%.
点评 本题考查了亚硫酸纯度的测定方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力.

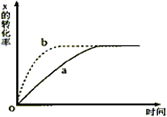 如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )
如图曲线a表示放热反应2X(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系,若要改变起始条件,使反应过程按b曲线进行,不可采取的措施是( )| A. | 升高温度 | B. | X的投入量增加 | C. | 加催化剂 | D. | 减小容器体积 |
| A | B | C | D | |
| 阳极 | 蓝 | 白 | 红 | 蓝 |
| 阴极 | 白 | 蓝 | 蓝 | 蓝 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 标准状况下,1mol任何物质的体积都约为22.4L | |
| B. | 1mol任何气体所含分子数都相同,体积也都约为22.4L | |
| C. | 同温同压下,相同体积的任何气体单质所含原子数目相同 | |
| D. | 常温常压下0.3mol H2、0.7mol N2组成的混合气体共含有NA个分子 |
| A. | 浓硝酸和稀硝酸都具有氧化性 | B. | 铜与硝酸的反应属于置换反应 | ||
| C. | 金属与硝酸反应不产生氢气 | D. | 可用铁或铝制品盛装浓硝酸 |
| A. | Na、Cl2、Br2 | B. | H2、N2O4、Cl2 | C. | I-、F2、H2O | D. | SO2、H+、HCl |
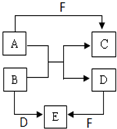 由短周期元素组成的中学常见的物质A、B、C、D、E、F的转化关系如图所示(部分反应条件略去):
由短周期元素组成的中学常见的物质A、B、C、D、E、F的转化关系如图所示(部分反应条件略去):