题目内容
11.浓硫酸的性质有:①酸性,②强氧化性,③吸水性,④脱水性.下列叙述分别表现了浓硫酸的哪种性质?(1)胆矾中加人浓硫酸,久置变为白色粉末:③(填序号,下同).
(2)浓硫酸可用铁制或铝制容器储存:②.
(3)铜和浓硫酸共热:①②.
(4)FeO与浓硫酸反应生成Fe2(SO4)3和SO2:①②.
分析 (1)浓硫酸具有吸水性,能够吸收晶体中的结晶水;
(2)浓硫酸具有强的氧化性,能够使铁铝钝化;
(3)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,依据反应中硫元素化合价变化判断;
(4)氧化亚铁与浓硫酸反应生成硫酸铁、二氧化硫和水,依据反应中硫元素化合价变化判断.
解答 解:(1)胆矾中加人浓硫酸,久置变为白色粉末,是因为浓硫酸吸收晶体结晶水,体现浓硫酸吸水性,
故选:③;
(2)浓硫酸具有强的氧化性,能够使铁铝钝化,形成致密氧化膜,阻止反应进行,所以可用铁制或铝制容器储存,体现浓硫酸强的氧化性;
故选:②;
(3)铜与浓硫酸反应生成硫酸铜、二氧化硫和水,浓硫酸中硫元素部分化合价变化,体现强的氧化性,部分化合价不变,体现酸性;
故选:①②;
(4)氧化亚铁与浓硫酸反应生成硫酸铁、二氧化硫和水,浓硫酸中硫元素部分化合价变化,体现强的氧化性,部分化合价不变,体现酸性;
故选:①②.
点评 本题考查了物质的性质,熟悉浓硫酸的性质是解题关键,注意吸水性与脱水性区别,注意钝化属于化学变化.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
1.下列变化过程,属于放热过程的是( )
| A. | 合成氨反应 | B. | 液态水变成水蒸气 | ||
| C. | 弱酸弱碱的电离 | D. | 灼热的炭与CO2的反应 |
2.下列烷烃中,一氯代物的同分异构体有2种,二氯代物的同分异构体有4种的是( )
| A. | 丙烷 | B. | 正丁烷 | C. | 异丁烷 | D. | 异戊烷 |
6.下列各组物质中,X是主体物质,Y是少量杂质,Z是除去杂质所要加入的试剂,其中所加试剂正确的一组是( )
| A | B | C | D | |
| X | FeCl2溶液 | FeCl3溶液 | Fe | Na2SO4溶液 |
| Y | FeCl3 | CuCl2 | Al | Na2CO3 |
| Z | Cl2 | Fe | NaOH溶液 | BaCl2溶液 |
| A. | A | B. | B | C. | C | D. | D |
7.20g A物质和14g B物质恰好完全反应,生成8.8g C物质、3.6g D物质和标准状况下4.48L气体E,则E物质的摩尔质量为( )
| A. | 100g/mol | B. | 108g/mol | C. | 55g/mol | D. | 96g/mol |
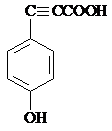 .
.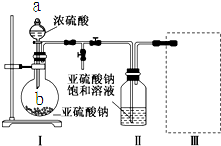 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验: