题目内容
1.下列变化过程,属于放热过程的是( )| A. | 合成氨反应 | B. | 液态水变成水蒸气 | ||
| C. | 弱酸弱碱的电离 | D. | 灼热的炭与CO2的反应 |
分析 A.大多数化合反应是放热反应;
B.水蒸气的能量比液态水高;
C.电离是吸热过程;
D.焦炭做还原剂的反应是吸热反应.
解答 A.合成氨反应属于化合反应,是放热反应,故A正确;
B.水蒸气的能量比液态水高,液态水变成水蒸气是吸热的,故B错误;
C.弱电解质的电离是吸热过程,故C错误;
D.热的炭与CO2的反应是吸热反应,故D错误.
故选A.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
相关题目
11.下列离子方程式错误的是( )
| A. | 向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | 等物质的量的MgCl2、Ba(OH)2 和 HC1溶液混合:Mg2++2OH-=Mg(OH)2↓ | |
| C. | 酸性介质中KMnO4氧化 H2O2:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O | |
| D. | 二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O |
12.原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
(1)X元素是H.
(2)X与W组成的化合物电子式为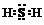 .
.
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O.
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A 与NaOH溶液反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶H2O.对化合物B进行如下实验:
2B的化学式为:(NH4)2SO4•FeSO4•6H2O.已知1mol/L 100mL B的溶液能与1mol/L 20mL KMnO4溶液(硫酸酸化)恰好反应.写出反应的离子方程式:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O.
(1)X元素是H.
(2)X与W组成的化合物电子式为
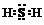 .
.(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O.
(4)由X、Y、Z、W四种元素组成的一种离子化合物A
①已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体.写出加热条件下A 与NaOH溶液反应的离子方程式NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
②又知A既能与盐酸反应,又能与氯水反应,写出A与氯水反应的离子方程式:SO32-+Cl2+H2O=SO42-+2Cl-+2H+.
(5)由X、Y、Z、W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶H2O.对化合物B进行如下实验:
| 操作 | 现象 |
| ①取B的溶液加入过量浓 NaOH溶液并加热 | 产生白色沉淀和无色刺激性气味气体; 过一段时间白色沉淀变为灰绿色,最终变为红褐色; |
| ②另取B的溶液, 加入过量BaCl2溶液 | 产生白色沉淀,加盐酸沉淀不溶解 |
9.常温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)=c(NH4+) | |
| B. | 新制氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-) | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) |
16.FeCl3、CuCl2混溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的( )
| A. | 加入KSCN的溶液一定不变红色 | B. | 溶液中一定含有Fe3+ | ||
| C. | 溶液中可能含Cu2+ | D. | 剩余固体中一定有铜 |
13.0.25L 1mol/L FeCl2溶液中的Cl-的物质的量浓度为( )
| A. | 1 mol/L | B. | 1.5 mol/L | C. | 2mol/L | D. | 3 mol/L |
10.若用NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 0.1 mol Cl2与足量的铁粉完全反应,转移的电子数为0.2NA | |
| B. | 2.3gNa与水完全反应生成H21.12L | |
| C. | NA个氧原子的质量约为32g | |
| D. | 标准状况下,2.24L CCl4含有的CCl4分子数为0.1NA |
 按要求写出下列化学方程式:
按要求写出下列化学方程式: .
.