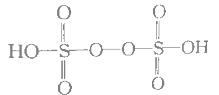
题目内容
【题目】Ⅰ、如图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都与氢原子结合。
(1)图中属于烷烃的是______ (填字母)。
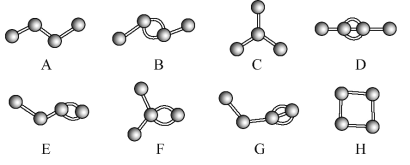
(2) 上图中互为同分异构体的是A与____;B与_____;D与____(填字母)。
Ⅱ、等物质的量的乙烯与甲烷,所含分子数之比_____,碳原子个数之比为_____,若充分燃烧,消耗O2的体积比为______;0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为______。
【答案】A、C C E、F、H G 1∶1 2∶1 3∶2 C6H12
【解析】
Ⅰ.小球表示碳原子,小棍表示化学键,每个C形成4个键,碳原子上其余的化学键都与氢原子结合,根据烷烃的概念和同分异构体分析解答;
Ⅱ.根据N=nNA可知,等物质的量的乙烯与甲烷,所含分子数相等,每个乙烯分子含有2个C原子、4个H原子,而每个甲烷分子含有1个C原子、4个H原子,据此计算碳原子数目之比;根据1molCxHy的耗氧量为(x+![]() )mol,计算二者耗氧量之比;根据原子守恒计算烃的分子式。
)mol,计算二者耗氧量之比;根据原子守恒计算烃的分子式。
Ⅰ.小球表示碳原子,小棍表示化学键,每个C形成4个键,碳原子上其余的化学键都与氢原子结合。
(1)烷烃分子中的碳碳键只有单键,且为链状结构,根据图示,只有A、C中含碳碳单键,为饱和链状结构,属于烷烃的是A、C,故答案为:A、C;
(2)同分异构体的分子式相同,但结构不同,A与C;B与E、F、H;D与G的分子式相同,结构不同,互为同分异构体,故答案为:C;E、F、H; G;
Ⅱ.根据N=nNA可知,等物质的量的乙烯与甲烷,所含分子数之比为1∶1,每个乙烯分子含有2个C原子、4个H原子,而每个甲烷分子含有1个C原子、4个H原子,可知碳原子数目之比为2∶1;1mol乙烯耗氧量为(2+![]() )mol=3mol,1mol甲烷耗氧量为(1+
)mol=3mol,1mol甲烷耗氧量为(1+![]() )mol =2mol,故等物质的量的乙烯与甲烷充分燃烧耗氧量之比为3mol∶2mol =3∶2;0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=
)mol =2mol,故等物质的量的乙烯与甲烷充分燃烧耗氧量之比为3mol∶2mol =3∶2;0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=![]() =6、N(H)=
=6、N(H)=![]() =12,故该烃的分子式为C6H12,故答案为:1∶1;2∶1;3∶2;C6H12。
=12,故该烃的分子式为C6H12,故答案为:1∶1;2∶1;3∶2;C6H12。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案