题目内容
16.运用相关化学知识进行判断,下列结论正确的是( )| A. | 某吸热反应能自发进行,因此该反应一定是熵增反应 | |
| B. | 合成氨的反应达到平衡后,给体系加压(压缩),活化分子百分数增加,所以反应速率加快 | |
| C. | 活化分子之间的碰撞都是有效碰撞,都能引发化学反应 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
分析 A.△H-T△S<0的反应能够自发进行;
B.给体系加压(压缩),活化分子百分数不变;
C.活化分子之间的碰撞不一定为有效碰撞,要有一定的取向;
D.浓硫酸与铁发生钝化反应.
解答 解:A.△H>0的反应能够自发进行时,△S必须大于0,故A正确;
B.给体系加压(压缩),活化分子百分数不变,但浓度增大,反应速率增大,故B错误;
C.活化分子之间的碰撞不一定为有效碰撞,当发生化学反应的碰撞才是有效碰撞,故C错误;
D.浓硫酸与铁反应不生成氢气,故D错误.
故选A.
点评 本题考查综合考查活反应速率的影响,为高频考点,侧重于双基的考查,题目难度不大,注意活化分子、有效碰撞以及活化能等概念的理解.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案
相关题目
7.100mL6.0mol•L-1H2SO4与过量的锌粉反应,在一定温度下,为了减缓反应速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A. | 硫酸铵固体 | B. | 硫酸钾溶液 | C. | NaHSO4固体 | D. | Na2CO3固体 |
4.化学与日常生活紧密相关,下列说法错误的是( )
| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶的透气小袋 | |
| C. | 二氧化硅可用于制备太阳能电池板 | |
| D. | 装饰材料释放的甲醛会造成污染 |
1.若NA表示阿伏加德罗常数,下列说法中,正确的是( )
| A. | 1molCl2作为氧化剂得到的电子数为NA | |
| B. | 在0℃,101kPa时,22.4L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64gSO2中含有的原子数为3NA | |
| D. | NA个一氧化碳分子和0.5mol甲烷的质量比为7:4 |
8.下列叙述中,正确的是( )
| A. | 氧化还原反应的本质是元素化合价发生了变化 | |
| B. | 含化合价升高元素的反应物被氧化 | |
| C. | 得到电子的物质被氧化 | |
| D. | 氧化还原反应中,氧化剂和还原剂一定是两种物质 |
6.下列化合物的同分异构体数目为7种的是(不考虑立体异构)( )
| A. | 丁醇 | B. | 丁烯 | C. | 一氯戊烷 | D. | 己烷 |
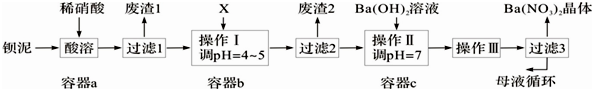
 我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1,.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.
我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1,.19g/cm3)配制成250mL 0.1mol•L-1的盐酸溶液.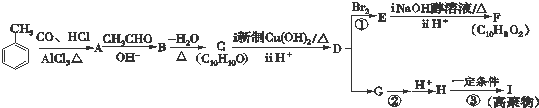

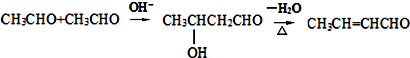
 .
. +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$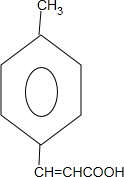 +Cu2O↓+2H2O.
+Cu2O↓+2H2O.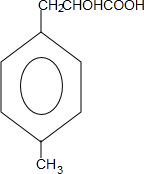 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$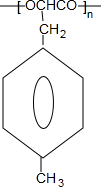 +nH2O.
+nH2O.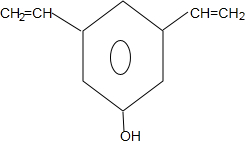
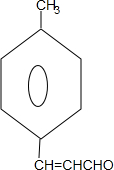
 .
.