题目内容
6.钡盐生产中排出大量的钡泥[主要含BaCO3、BaSO3、Ba(FeO2)2等],某主要生产BaCO3的化工厂利用钡泥制取Ba(NO3)2晶体及其他副产物,其部分工艺流程如下: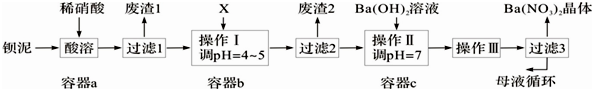
已知:i.Fe(OH)3和Fe(OH)2完全沉淀时,溶液的pH分别为3.2和9.7.
ii.Ba(NO3)2在热水中溶解度较大,在冷水中溶解度较小.
iii.KSP(BaSO4)=1.1×10-10,KSP(BaCO3)=5.1×10-9.
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌,过滤,洗涤.用离子方程式说明提纯原理:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq).
(2)上述流程酸溶时,Ba(FeO2)2与HNO3反应生成两种硝酸盐,化学方程式为:Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O.
(3)该厂结合本厂实际,选用的X为③(从下列选项中选择);废渣2为Fe(OH)3(写出化学式).
①BaCl2 ②Ba(NO3)2 ③BaCO3 ④Ba(OH)2
(4)过滤3后的母液应循环到容器c中.(填“a”、“b”或“c”)
(5)称取w g晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m g,则该Ba(NO3)2的纯度为$\frac{261m}{233w}$×100%.
分析 钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化;
(2)Ba(FeO2)2与HNO3反应生成Ba(NO3)2和Fe(NO3)3,以此确定反应的化学方程式;
(3)X既要能消耗硝酸,又不产生新杂质,结合本厂实际,故可用BaCO3;
(4)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,可循环使用;
(5)根据沉淀硫酸钡的质量,结合方程式计算求出硝酸钡的质量,再求样品的纯度.
解答 解:钡泥主要含BaCO3、BaSO3、Ba(FeO2)2等,加入硝酸,在a容器中充分溶解,可生成硫酸钡,过滤后滤液中含有铁离子、钡离子等,且溶液呈酸性,可加入碳酸钡,调节溶液pH=4~5,使铁离子水解生成Fe(OH)3沉淀,过滤后废渣2为Fe(OH)3,滤液中含有硝酸、硝酸钡等,加入氢氧化钡中和得到硝酸钡溶液,经蒸发、浓缩、过滤可得到硝酸钡晶体,母液中含有硝酸钡,
(1)溶液存在BaSO4(aq)+CO32-(aq)?BaCO3(aq)+SO42-(aq),增大碳酸根离子的浓度,当c(CO32-)×c(Ba2+)>Ksp(BaCO3)时,可实现沉淀的转化,
使平衡正向移动从而除去BaSO4杂质,
故答案为:BaSO4(s)+CO32-(aq)?BaCO3(s)+SO42-(aq);
(2)Ba(FeO2)2与中钡元素为+2价,铁元素为+3价,所以反应产物为Ba(NO3)2和Fe(NO3)3,所以其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3=Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)X既要能中和硝酸,又不产生新杂质,结合工厂实际,应该用BaCO3来调节pH,由以上分析可知过滤后废渣2为Fe(OH)3,
故答案为:③;Fe(OH)3;
(4)通过蒸发浓缩、冷却结晶、过滤,得到硝酸钡晶体,剩余的滤液中仍含有少量的Ba(NO3)2,所以含有Ba(NO3)2的母液应该,循环到容器c中,
故答案为:c;
(5)称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量沉淀质量为m克,其发生的反应为:Ba(NO3)2+H2SO4=BaSO4+2HNO3,
设参加反应的Ba(NO3)2为xg,
Ba(NO3)2+H2SO4=BaSO4+2HNO3
261 233
x mg
则 $\frac{261}{x}$=$\frac{233}{mg}$,解得x=$\frac{261m}{233}$,所以该Ba(NO3)2的纯度为$\frac{\frac{261m}{233}}{w}$×100%=$\frac{261m}{233w}$×100%=
故答案为:$\frac{261m}{233w}$×100%.
点评 本题考查学生在“工艺流程阅读、相关反应化学方程式书写、化学反应条件控制的原理、生产流程的作用”等方面对元素化合物性质及其转化关系的理解和应用程度,综合考查学生对新信息的处理能力、分析能力和实验能力,题目难度中等,注意把握实验原理和方法.

| A. | 等浓度的溶液中滴入稀盐酸.放出气体的快慢Na2C03<NaC03 | |
| B. | 热稳定性Na2C03<NaHC03 | |
| C. | 常温时水溶性Na2C03<NaHC03 | |
| D. | 相对分子质量Na2C03<NaHC03 |
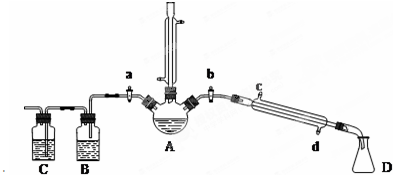
(1)仪器A的名称是三颈烧瓶.
(2)关闭a和b、接通竖直冷凝管的冷凝水,给A加热30分钟,制备1-溴丁烷.写出该反应的化学方程式三颈烧瓶.
(3)理论上,上述反应的生成物还可能有:丁醚、1-丁烯、溴化氢等.熄灭A处酒精灯,在竖直冷凝管上方塞上塞子,打开a,利用余热继续反应直至冷却,通过B、C装置检验部分副产物.B、C中应盛放的试剂分别是硝酸银、高锰酸钾溶液或溴水.
(4)在实验过程中,发现A中液体由无色逐渐变成黑色,该黑色物质与浓硫酸反应的化学方程式为C+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,可在竖直冷凝管的上端连接一个内装吸收剂碱石灰的干燥管,以免污染空气.
(5)相关有机物的数据如下:
| 物质 | 熔点/0C | 沸点/0C |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
(6)若实验中所取1-丁醇、NaBr分别为7.4g、13.0g,蒸出的粗产物经洗涤、干燥后再次蒸馏得到9.6g 1-溴丁烷,则1-溴丁烷的产率是.
| A. | G→a→c→f→b→d→c→b | B. | G→c→b→d→c→f→c→a | C. | G→a→e→f→b→d→c | D. | G→b→f→a→d→c→b |
| A. | ①中的离子反应方程式是:Na++NH3+CO2+H2O=NaHCO3↓+NH4+ | |
| B. | ②中的离子反应方程式是:2Na++CO32-+H2O+CO2=2NaHCO3↓ | |
| C. | 上述变化说明相同温度下溶解度Na2CO3>NaHCO3>NaCl | |
| D. | 向饱和CaCl2溶液中加入浓Ba(OH)2溶液,也会析出晶体 |
| A. | 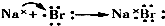 | B. |  | ||
| C. |  | D. | 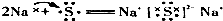 |
| A. | 某吸热反应能自发进行,因此该反应一定是熵增反应 | |
| B. | 合成氨的反应达到平衡后,给体系加压(压缩),活化分子百分数增加,所以反应速率加快 | |
| C. | 活化分子之间的碰撞都是有效碰撞,都能引发化学反应 | |
| D. | 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率 |
 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如图操作: