题目内容
【题目】(1)某元素原子的价电子构型为4s24p1,该元素的符号为________。
(2)某元素+3价离子的3d轨道半充满,该元素的符号为________。
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,A的离子结构示意图为________,B的元素名称为________。
(4)如图,第一电离能I1是指气态原子X(g)处于基态时,失去一个电子成为气态阳离子X+(g)所需的能量。如图是部分元素原子的第一电离能I1随原子序数变化的曲线(其中12~17号元素的有关数据缺失)。
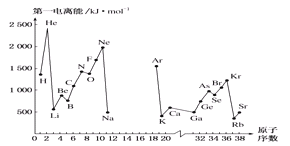
①认真分析图中同周期元素第一电离能的变化规律,推断Na~Ar元素中,Al的第一电离能的大小范围为________<Al<________;(填元素符号)。
②图中第一电离能最小的元素在周期表中的位置是第________周期________族。
【答案】Ga Fe ![]() 钙 Na Mg 五 IA
钙 Na Mg 五 IA
【解析】
(1)元素元素价电子构型为4s24p1,处于P区,为主族元素,为第四周期第ⅢA族元素Ga;
(2)元素+3价离子的3d轨道半充满,该离子的电子排布式为1s22s22p63s23p63d5,故原子的核电荷数为23+3=26,为Fe元素;
(3)A元素的负二价离子和B元素的正二价离子的电子层结构都与氩相同,核外电子数为18,A原子质子数为16,B原子质子数为20,故A为S元素,B为Ca元素,S2-离子的结构示意图为:![]() ;
;
(4)①由图可知第ⅡA、ⅤA族元素的第一电离能有突变,因此Al的第一电离能的最小范围为Na<Al<Mg;
②金属性越强,越容易失去电子,所以第一电离能越小,图中第一电离能最小的元素是铷,在第五周期IA族。

【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D是同周期中原子半径最小的元素 |
E | E元素在同周期中金属性最强 |
F | F元素的最外层电子数等于周期序数 |
G | G元素原子M层上电子数比L上少2个电子。 |
(1)G在元素周期表中的位置________。
(2)B最简单气态氢化物的结构式____,属于____化合物(填“离子”或“共价”);E的最高价氧化物的水化物电子式____,所含化学键类型________。
(3)C、D、E、F、G简单离子半径由大到小顺序为:____(填离子符号)。
(4)用电子式表示G的氢化物的形成过程______。
(5)A元素的某氧化物与E元素的某含氧化合物反应生成单质的化学方程式是_______。
(6)E、F两元素最高价氧化物对应水化物相互反应的离子方程式:____。
【题目】四氯化锡可用作媒染剂。利用如图所示装置可以制备四氯化锡(部分夹持装置已略去);

有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)戊装置中冷凝管的进水口为___________(填“a”或“b”)。
(2)用甲装置制氯气,MnO4-被还原为Mn2+,该反应的离子方程式为________________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到___________(填现象)后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:①促进氯气与锡反应;②_______________________________。
(4)如果缺少乙装置,可能产生的后果是___________________;己装置的作用是__________________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2 的有_______________(填标号)。
a.FeCl3溶液(滴有KSCN) b.H2O2溶液 C.溴水 d.AgNO3溶液
(6)反应中用去锡粒1.19g,反应后在戊装置的试管中收集到2.38 gSnCl4,则SnCl4的产率为____________________。