题目内容
(1)含0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是 .0.3mol NH3分子中所含氢原子数与 个H2O分子中所含氢原子数相等.如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数) L.
(2)锂离子电池的应用很广泛,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔和铝箔等,其中钴酸锂的回收用到“酸浸”,即在80℃、H2SO4和H2O2作用下生成Li2SO4和CoSO4,请写出该反应的化学方程式 ,有人提出因为盐酸也具有 (填性质)可以代替H2SO4和H2O2;但该提议却不被生产厂家所采纳,你认为其原因最可能是 .
(2)锂离子电池的应用很广泛,其正极材料可再生利用.某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔和铝箔等,其中钴酸锂的回收用到“酸浸”,即在80℃、H2SO4和H2O2作用下生成Li2SO4和CoSO4,请写出该反应的化学方程式
考点:物质的量浓度的相关计算,物质的量的相关计算
专题:计算题
分析:(1)由电荷守恒可知,溶液中n(SO42-)=
n(Al3+);
根据氨气分子中含有H原子数目计算H原子物质的量,进而计算水分子物质的量,再根据N=nNA计算水分子数目;
同种气体,其质量与分子数成正比,据此计算cg气体含有分子数目,然后根据n=
气体物质的量,再V=n×Vm计算体积;
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成.
| 3 |
| 2 |
根据氨气分子中含有H原子数目计算H原子物质的量,进而计算水分子物质的量,再根据N=nNA计算水分子数目;
同种气体,其质量与分子数成正比,据此计算cg气体含有分子数目,然后根据n=
| N |
| NA |
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成.
解答:
解:(1)0.4mol Al3+的Al2(SO4)3中所含的SO42-的物质的量=0.4mol×
=0.6mol;
与0.3mol NH3分子中所含氢原子数相等的水的物质的量=
=0.45mol,故水分子数目=0.45mol×NAmol-1=0.45NA;
a克某气体中含有的分子数为b,则c克气体含有的分子数为
,c克该气体的物质的量为
=
mol,在标准状况下,cg气体的体积=
molmol×22.4L/mol=
L,
故答案为:0.6mol;0.45NA;
;L.
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,反应方程式为:2LiCoO2+H2O2+3H2SO4
Li2SO4+2CoSO4+O2↑+4H2O,因为盐酸也具有强酸性和还原性,理论上可以代替H2SO4和H2O2,但上述反应可知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,
故答案为:2LiCoO2+H2O2+3H2SO4
Li2SO4+2CoSO4+O2↑+4H2O;强酸性和还原性;有氯气生成,污染较大.
| 3 |
| 2 |
与0.3mol NH3分子中所含氢原子数相等的水的物质的量=
| 0.3mol×3 |
| 2 |
a克某气体中含有的分子数为b,则c克气体含有的分子数为
| cb |
| a |
| ||
| NAmol-1 |
| bc |
| aNA |
| bc |
| aNA |
| 22.4bc |
| aNA |
故答案为:0.6mol;0.45NA;
| 22.4bc |
| aNA |
(2)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,Co元素化合价降低,则过氧化氢被氧化为氧气,同时生成水,反应方程式为:2LiCoO2+H2O2+3H2SO4
| ||
故答案为:2LiCoO2+H2O2+3H2SO4
| ||
点评:本题考查物质的量的有关计算、氧化还原反应,属于拼合型题目,(2)中注意对氧化还原反应的理解,从题目中获取信息,本题难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
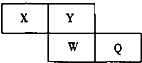 短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.Y是地壳中含量最多的元素.下列说法正确的是( )
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.Y是地壳中含量最多的元素.下列说法正确的是( )| A、1mol Q单质与氢氧化钠溶液反应转移的电子数目为2NA |
| B、X的气态氢化物能使湿润的蓝色石蕊试纸变红 |
| C、氢化物的沸点:H2Y>HQ |
| D、最髙价氧化物的水化物的酸性:W>Q |
把a L硫酸铵和硝酸铵混合液分成两等份,一份需用b mol烧碱刚好把氨全部赶出,另一份与BaCl2溶液反应恰好消耗c mol BaCl2.原则溶液中NO3-的物质的量浓度是( )
A、
| ||
B、
| ||
C、
| ||
D、
|


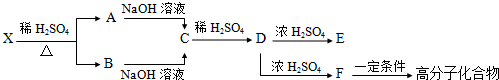
 【化学-选修5:有机化学基础】
【化学-选修5:有机化学基础】