题目内容
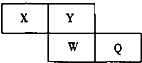 短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.Y是地壳中含量最多的元素.下列说法正确的是( )
短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示.Y是地壳中含量最多的元素.下列说法正确的是( )| A、1mol Q单质与氢氧化钠溶液反应转移的电子数目为2NA |
| B、X的气态氢化物能使湿润的蓝色石蕊试纸变红 |
| C、氢化物的沸点:H2Y>HQ |
| D、最髙价氧化物的水化物的酸性:W>Q |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示,Y是地壳中含量最多的元素,则Y是O元素,X为N元素、W为S元素、Q为Cl元素,
A.Cl2+2NaOH=NaCl+NaClO+H2O,根据氯气和转移电子之间的关系式计算;
B.X的气态氢化物是氨气,氨气能使湿润的蓝色石蕊试纸变红色;
C.氢键导致氢化物的沸点升高;
D.非金属性越强,其最高价氧化物的水化物酸性越强.
A.Cl2+2NaOH=NaCl+NaClO+H2O,根据氯气和转移电子之间的关系式计算;
B.X的气态氢化物是氨气,氨气能使湿润的蓝色石蕊试纸变红色;
C.氢键导致氢化物的沸点升高;
D.非金属性越强,其最高价氧化物的水化物酸性越强.
解答:
解:短周期元素X、Y、W、Q在元素周期表中的相对位置如图所示,Y是地壳中含量最多的元素,则Y是O元素,X为N元素、W为S元素、Q为Cl元素,
A.Cl2+2NaOH=NaCl+NaClO+H2O,该反应中Cl元素化合价由0价变为-1价、+1价,所以1mol Q单质与氢氧化钠溶液反应转移的电子数目为NA,故A错误;
B.X的气态氢化物是氨气,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使氨水溶液呈碱性,所以氨气能使湿润的蓝色石蕊试纸变红色,故B正确;
C.氢键导致氢化物的沸点升高,Y氢化物中含有氢键、Q氢化物中不含氢键,所以氢化物沸点H2Y>HQ,故C正确;
D.非金属性越强Q>W,最髙价氧化物的水化物的酸性:W<Q,故D错误;
故选BC.
A.Cl2+2NaOH=NaCl+NaClO+H2O,该反应中Cl元素化合价由0价变为-1价、+1价,所以1mol Q单质与氢氧化钠溶液反应转移的电子数目为NA,故A错误;
B.X的气态氢化物是氨气,氨气和水反应生成一水合氨,一水合氨电离出氢氧根离子而使氨水溶液呈碱性,所以氨气能使湿润的蓝色石蕊试纸变红色,故B正确;
C.氢键导致氢化物的沸点升高,Y氢化物中含有氢键、Q氢化物中不含氢键,所以氢化物沸点H2Y>HQ,故C正确;
D.非金属性越强Q>W,最髙价氧化物的水化物的酸性:W<Q,故D错误;
故选BC.
点评:本题考查了元素周期表和元素周期律综合应用,根据元素物质确定元素,再结合物质性质分析解答,利用B选项现象可以检验氨气,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列有关化学用语表示正确的是( )
| A、乙酸的结构简式:C2H4O2 |
| B、中子数为20的氯原子:1720Cl |
C、F-的结构示意图: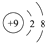 |
D、NH4Br的电子式: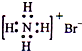 |
CH4中混有C2H4,欲除去C2H4得到纯净的CH4,最好依次通过盛有下列哪一组试剂的洗气瓶( )
| A、澄清石灰水,浓H2SO4 |
| B、酸性KMnO4溶液,浓H2SO4 |
| C、Br2水,浓H2SO4 |
| D、浓H2SO4,酸性KMnO4溶液 |
下列除杂的方法合理可行的是( )
| A、将混合气体通过灼热的氧化铜除去N2中混有的O2 |
| B、通入足量的CO2可除去NaHCO3溶液中混有的Na2CO3 |
| C、加入浓溴水,再过滤可以除去苯中混有少量的苯酚 |
| D、KNO3溶液中混有少量K2SO4可以通过加入适量BaCl2溶液并过滤来提纯 |
近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深.Butylated Hydroxy Toluene(简称BHT)是一种常用的食品抗氧化剂,合成方法有如下两种:下列说法正确的是( )
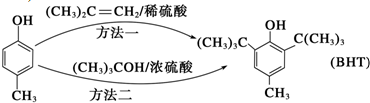

A、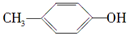 能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 |
| B、BHT久置于空气中不会被氧化 |
| C、两种方法的反应类型都是加成反应 |
D、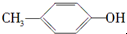 与BHT互为同系物 与BHT互为同系物 |
下列有关叙述错误的是( )
A、水分子的结构式为 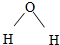 |
| B、氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 |
C、Na2O2的电子式为Na+ Na+ Na+ |
D、在MgO晶体中,O2-的结构示意图可表示为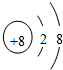 |
下列说法正确的是( )
| A、发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B、金属阳离子被还原后,不一定得到该元素的单质 |
| C、核外电子总数相同的粒子,一定是同种元素的原子 |
| D、只能与酸反应的氧化物,一定是碱性氧化物 |