题目内容
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
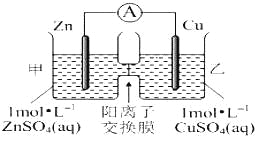
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的C(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阳离子通过交换膜向正极移动,阴离子通过交换膜向负极移动,保持溶液中电荷平衡
【答案】C
【解析】试题分析:A、由图像可知该原电池反应原理为Zn+Cu2+= Zn2++Cu,故Zn电极为负极失电子发生氧化反应,Cu电极为正极得电子发生还原反应,A错误;B、该装置中为阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,B正确;C、电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池,乙池中Cu2++2e—= Cu,故乙池中为Cu2+~Zn2+,摩尔质量M(Zn2+)>M(Cu2+),故乙池溶液的总质量增加,C错误;D、该装置中为阳离子交换膜只允许阳离子和水分子通过,电解过程中溶液中Zn2+由甲池通过阳离子交换膜进入乙池保持溶液中电荷平衡,阴离子并不通过交换膜,D错误;答案选B。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目








