题目内容
下面叙述正确的是 ( )
| A.共价化合物中没有离子键 |
| B.离子化合物中没有共价键 |
| C.正四面体构型的分子,键角均为109°28' |
| D.直线型分子中的键角均为180° |
A
解析试题分析:A、共价化合物只含共价键,不含离子键,正确;B、离子化合物含有离子键,也可能含有共价键,如NaOH等,错误;C、正四面体构型的分子,键角可能为109°28',如CH4,也可能为600,如P4,错误;D、直线型分子若为双原子分子,如HCl等,只含一个共价键,没有键角,错误。
考点:本题考查化学键、键角。

练习册系列答案
相关题目
下列物质中,既含离子键又含共价键的是
| A.CaCl2 | B.NH4Cl | C.CCl4 | D.CO2 |
下列说法不正确的是
| A.HCl、HBr、HI的熔点沸点升高与范德华力大小有关 |
| B.H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 |
| C.乙醇与水互溶可以用相似相溶原理解释 |
| D.甲烷与水分子间不能形成氢键这种化学 |
三氟化硼(BF3)是一种无色气体,用于制造火箭的高能燃料。已知BF3是非极性分子,下列描述正确的是
| A.BF3分子呈三角锥形 | B.BF3沸点低于BCl3 |
| C.B-F键键能低于B-Cl键 | D.F-B-F间的夹角为109°28′ |
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷(P4)相同,如图所示,已知断裂1molN-N键吸收167KJ能量,生成1mol 放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )
放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )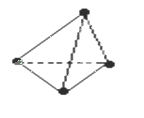
| A.N4分子是一种新型化合物 |
| B.N4和N2互为同素异形体 |
| C.N4比N2稳定 |
| D.1molN4转变为N2将吸收882KJ的能量 |
下列叙述正确的是( )
| A.P4和NO2都是共价化合物 |
| B.CCl4和NH3都是以极性键结合的极性分子 |
| C.在CaO和SiO2晶体中,都不存在单个小分子 |
| D.在冰(固态水)中,既有极性键、非极性键,又有氢键 |
已知大多数含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大于等于2的是强酸,m为0的是弱酸。下列各含氧酸中酸性最强的是
| A.H2SeO3 | B.HMnO4 | C.H3BO3 | D.H3PO4 |
下列分子中既有极性键,又有非极性键的是
| A.C2H4 | B.H2 | C.Na2O | D.NH3 |
BF3与BCl3分子的空间构型均为平面正三角形,下列有关二者的比较中,正确的是
| A.分子中各原子最外层都满足8电子稳定结构 |
| B.键角均为60°,都是含有极性键的极性分子 |
| C.BF3沸点低于BCl3沸点,因为B-F键键长短 |
| D.BF3分子稳定性高于BCl3,因为B-F键键能高 |