题目内容
18. 碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2:1.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验 序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注).
分析 (1)慢反应中有I2生成,使溶液变蓝色,而快反应中消耗I2,慢反应决定反应速率,慢反应中生成I2大于快反应中消耗的I2,可以观察到溶液变蓝色;
(2)实验目的是探究反应物浓度对化学反应速率的影响,由表中数据可知,KI溶液、Na2S2O3溶液用量相等,应是探究K2S2O8浓度对反应速率的影响,保持溶液总体积相等;
(3)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短.
解答 解:(1)慢反应中有I2生成,使溶液变蓝色,而快反应中消耗I2,慢反应决定反应速率,当溶液中的 S2O32-或Na2S2O3耗尽后,碘才能与淀粉作用显示蓝色;
根据I2+2S2O32-═S4O62-+2I- (快)可知,1mol碘需2molS2O32-,根据方程式S2O82-+2I-═2SO42-+I2可知,生成1mol碘需为1molS2O82-,为确保能观察到蓝色,碘需有剩余,即n(S2O32-):n(S2O82-)<2:1,
故答案为:S2O32-或Na2S2O3;<2:1;
(2)实验目的是探究反应物浓度对化学反应速率的影响,由表中数据可知,KI溶液、Na2S2O3溶液用量相等,应是探究K2S2O8浓度对反应速率的影响,保持溶液总体积相等,即其他条件不变,只改变反应物K2S2O8浓度,从而才达到对照实验目的,故Vx=10.0mL-8.0mL=2.0mL,
故答案为:2.0;保证溶液总体积不变,即其他条件不变,只改变反应物K2S2O8浓度,从而才达到对照实验目的;
(3)保持其它条件不变,降低温度,反应速率降低,到达液颜色将由无色变成为蓝色的时间变长,而使用催化剂,能加快化学反应速率,所以到达液颜色将由无色变成为蓝色的时间变短,降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图为: ,
,
故答案为: .
.
点评 本题考查反应速率影响因素的探究实验、化学计算等,(2)中注意利用控制变量法分析解答,难度中等.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 卢瑟福通过α粒子散射实验,证明了电子的存在 | |
| B. | 188O、168O、11H、21H 可以构成六种水分子,他们属于同种物质 | |
| C. | 3717Cl和3517Cl互为同素异形体,最外层电子数都等于7 | |
| D. | 现发现的自然界核素只有100多种,且大多数为金属 |
(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式是C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=$\frac{9}{16}$.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)ab.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是ab.
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属.若0.5mol碳完全与赤铁矿(Fe2O3)反应,得到0.6mol铁,同时生成2种常见气体CO和CO2,则该反应的化学方程式是5C+3Fe2O3$\frac{\underline{\;高温\;}}{\;}$4CO2↑+CO↑+6Fe.
| A. | 某氢化物的溶液能使石蕊试液变蓝,该氢化物一定是氨气 | |
| B. | 在Fe(OH)3胶体中和Fe(NO3)3溶液中分别逐滴加入HI稀溶液至过量,整个过程中现象相同 | |
| C. | 配制硫酸亚铁溶液时应将硫酸亚铁固体溶于浓硫酸中,再稀释至所需浓度,以防止水解 | |
| D. | 酸性高锰酸钾溶液、品红溶液、硫化钠溶液都能将SO2和CO2气体区别开 |
| A. | 1,5-二甲苯 | B. | 间二甲苯 | C. | 邻二甲苯 | D. | 1,4-二甲苯 |
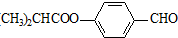 G的一种合成路线如下:
G的一种合成路线如下: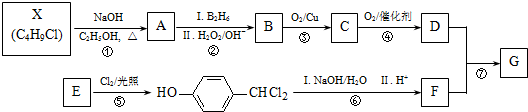
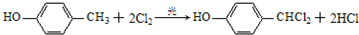 .
. .
. .
.