题目内容
13.碳单质在工业上有多种用途.(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6kJ热量.该反应的热化学方程式是C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1.
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
物质 T/℃n/mol | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2.
Ⅰ.计算K1=$\frac{9}{16}$.
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)ab.
a.T1>T2 b.T1<T2 c.无法比较
③在T1温度下反应达到平衡后,下列措施不能改变NO的转化率的是ab.
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(3)工业上可用焦炭冶炼金属.若0.5mol碳完全与赤铁矿(Fe2O3)反应,得到0.6mol铁,同时生成2种常见气体CO和CO2,则该反应的化学方程式是5C+3Fe2O3$\frac{\underline{\;高温\;}}{\;}$4CO2↑+CO↑+6Fe.
分析 (1)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此结合热化学方程式书写原则进行书写;
(2)、①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
③根据平衡移动原理分析解答,
a.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动;
b.该反应前后气体的物质的量不变,增大压强,平衡不移动;
c.反应移动存在热效应,升高温度,平衡一定移动;
d.移去部分生成物F,平衡向正反应移动;
(3)0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,气体为CO2、CO,令生成CO2、CO的物质的量分别为xmol、ymol,根据C原子守恒有x+y=0.5,根据电子转移守恒有4x+2y=0.6×3,联立计算x、y的值,确定CO2、CO的系数关系,配平书写方程式.
解答 解:(1)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式为:
C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ•mol-1;
(2)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C+2NO?N2+CO2,
故答案为:C+2NO?N2+CO2;
②Ⅰ、平衡时c(NO)=$\frac{0.04mol}{2L}$=0.02mol/L,c(N2)=c(CO2)=$\frac{0.03mol}{2L}$=0.015mol/L,故T1℃时该反应的平衡常数为K1=$\frac{0.015×0.015}{0.0{2}^{2}}$=$\frac{9}{16}$,故答案为:$\frac{9}{16}$;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
③a.增大c(NO),相当于增大压强,该反应前后气体的物质的量不变,平衡不移动,NO的转化率不变,故a符合;
b.该反应前后气体的物质的量不变,增大压强,平衡不移动,NO的转化率不变,故b符合;
c.反应移动存在热效应,升高温度,平衡一定移动,NO转化率一定变化,故c不符合;
d.移去部分生成物F,平衡向正反应移动,NO的转化率增大,故d不符合;
故答案为:ab;
(3)0.5mol碳完全与赤铁矿反应,得到0.6mol铁,同时生成2种常见气体,气体为CO2、CO,令生成CO2、CO的物质的量分别为xmol、ymol,根据C原子守恒有x+y=0.5,根据电子转移守恒有4x+2y=0.6×3,联立解得x=0.4、y=0.1,CO2、CO的系数为4:1,故该反应的方程式为:5C+3Fe2O3 $\frac{\underline{\;高温\;}}{\;}$4CO2↑+CO↑+6Fe,
故答案为:5C+3Fe2O3$\frac{\underline{\;高温\;}}{\;}$4CO2↑+CO↑+6Fe.
点评 考查平衡常数及化学平衡的有关计算、平衡的移动等,难度中等,(3)中关键是确定二氧化碳与一氧化碳的化学计量数关系.

 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案| A. | x+n | B. | x-n | C. | n | D. | n+2 |
| t/min | 1 | 2 | 3 | 4 |
| c(N2O5)/mol.L-1 | 0.133 | 0.080 | 0.057 | 0.040 |
| v正/mol.L-1.min-1 | 0.0466 | 0.028 | 0.020 | 0.014 |
| A. | 340K时,速率表达式中m=1 | |
| B. | 340K时,速率表达式中k正≈0.35min-1 | |
| C. | 340K时,若c(N2O3)=0.100mol.L-1,则v正≈0.035mol.L-1.min-1 | |
| D. | 若t=2min时升高温度,则m不变,k正减小 |
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(l)△H=-1452.8KJ/mol.
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | 391 | 945 |
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算.
已知:C(s,石墨)+02(g)=C02(g)△H1=-akJ•mol-1
2H2(g)+02(g)=2H20(l)△H2=-bkJ•mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l)△H3=-ckJ•mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=(0.5c-0.5b-2a)kJ•mol-1.
 碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
碘在科研与生活中有重要作用,某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.已知:S2O82-+2I-═2SO42-+I2(慢)
I2+2S2O32-═2I-+S4O62- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的S2O32-或Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<2:1.
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如表:
| 实验 序号 | 体积V/mL | ||||
| K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
| ① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
| ② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
| ③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~反应时间t的变化曲线示意图(进行相应的标注).
| A. | 化学反应中的能量变化都表现为热量变化 | |
| B. | 需要加热才能发生的反应不一定是吸热反应 | |
| C. | 任何化学反应过程中都伴随有能量的变化 | |
| D. | 反应物和生成物所具有的总能量决定了反应是放热还是吸热 |
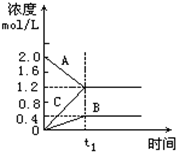 如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间,t1为2分钟.试回答:
如图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间,t1为2分钟.试回答: