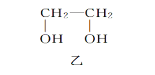题目内容
【题目】铜是人类发现最早并广泛使用的一种金属。溶液中Cu2+的浓度可采用碘量法测得:
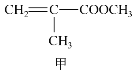
①2Cu2++5I-=2CuI↓+![]()
②![]() +2
+2![]() =
=![]() +3I-
+3I-
现取某20.00mL含Cu2+的溶液。加入足量的KI充分反应后,用0.1000mo1·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液体积如表所示。
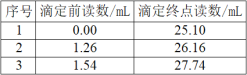
(1)溶液中Cu2+的浓度为___mol·L-1。
(2)用移液管量取20.00mLCu2+的溶液时俯视刻度线,最终测得的Cu2+的浓度将___(“偏高、偏低或无影响”)。
【答案】0.1250mol·L-1 偏低
【解析】
根据反应的方程式得出关系式计算铜离子浓度;根据俯视刻度线读数偏小分析误差。
(1)根据表中数据三次实验消耗Na2S2O3溶液体积分别是25.10mL、24.90mL、26.20mL,第三次实验误差大,舍去,消耗Na2S2O3溶液体积的平均值是25.00mL,因此消耗Na2S2O3的物质的量是0.025L×0.1mol/L=0.0025mol,根据方程式2Cu2++5I-=2CuI↓+![]() 、I
、I![]() +2
+2![]() =
=![]() +3I-可知2Cu2+~
+3I-可知2Cu2+~![]() ~2
~2![]() ,则铜离子的物质的量是0.0025mol,其浓度是
,则铜离子的物质的量是0.0025mol,其浓度是![]() =0.1250mol·L-1;
=0.1250mol·L-1;
(2)用移液管量取20.00mLCu2+的溶液时俯视刻度线,读数偏小,因此导致消耗Na2S2O3溶液体积偏小,所以最终测得的Cu2+的浓度将偏低。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有少量不与酸作用的可溶性杂质,试根据实验回答:
(1)准确称取4.0g烧碱样品。
(2)将样品配成250mL待测液。
(3)用____________(填仪器名称)量取25.00mL待测液于锥形瓶中,并滴加几滴甲基橙作指示剂。
(4)用0.2010 mol·L-1标准盐酸滴定待测烧碱溶液,滴定时,两眼注视____________,直到滴定终点。达到终点的具体现象是:____________。
(5)若两次实验滴定的数据如下表:
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 25.00 | 0.50 | 20.40 |
第二次 | 25.00 | 5.00 | 28.30 |
第三次 | 25.00 | 4.00 | 24.10 |
根据上述各数据,计算烧碱的纯度:____________
(6)下列操作中,会导致所测得的烧碱的纯度偏大的是________。
a.滴定终点时,俯视刻度
b.没有用盐酸标准溶液润洗相应的滴定管
c.锥形瓶中有少量的蒸馏水