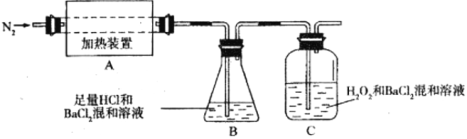
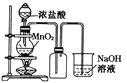
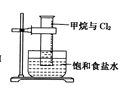
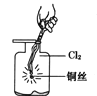
题目内容
【题目】醇的官能团名称是______,结构简式为______;羧酸的官能团名称是______,结构简式为_______。二者在一定条件下发生反应的类型是______,写出乙酸和乙醇反应的化学方程式___________________________________。
【答案】羟基 -OH 羧基 -COOH 取代反应 CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
【解析】
醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物,其官能团为羟基,结构简式为—OH;由烃基和羧基相连构成的有机化合物称为羧酸,其官能团名称为羧基,结构简式为—COOH,醇和羧酸在浓硫酸作催化剂的条件下,发生酯化反应(或取代反应)生成酯类。在酯化反应中,醇脱去羟基中的H,羧酸脱去羧基中的羟基,生成酯和水,乙酸和乙醇反应的化学方程式为CH3COOH+CH3CH2OH ![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。

练习册系列答案
相关题目