题目内容
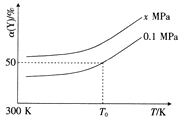
【题目】对可逆反应N2(g)+3H2(g)2NH3(g)△H<0,下列图象正确的是( )
A.
B.
C.
D.
【答案】C
【解析】解:A、压强增大反应速率增大,先到达平衡,故压强P2>P1,增大压强平衡向气体体积减小的方向移动进行,氨气的体积分数增大,图象与实际不相符,故A错误;
B、升高温度平衡向逆反应方向移动,氮气的转化率降低,图象中温度越高氮气的转化率越大,与实际不相符,故B错误;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动,图象与实际相符合,故C正确;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间,图象中没有使用催化剂到达平衡的时间短,与实际不符,故D错误,
故选C.
A、压强增大反应速率增大,平衡向气体体积减小的方向移动,氨气的体积分数增大;
B、升高温度平衡向逆反应方向移动,氮气的转化率降低;
C、增大氮气的浓度,瞬间正反应速率增大,逆反应速率不变,平衡向正反应方向移动;
D、催化剂同等程度增大反应速率,不改变化学平衡,缩短到达平衡的时间.

练习册系列答案
相关题目
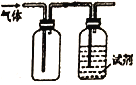
【题目】用如图装置做相应实验,收集方法及所加试剂、现象、结论均正确的是
选项 | 气体 | 试剂 | 现象 | 结论 |
|
A | X | 酸性KMnO4溶液 | 溶液褪色 | X一定是SO2 气体 | |
B | NH3 | 酚酞溶液 | 溶液变红色 | 氨水呈碱性 | |
C | NO2 | 淀粉一KI溶液 | 溶液变蓝色 | NO2有还原性 | |
D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水有酸性和漂白性 |
A. A B. B C. C D. D