题目内容
【题目】碱式碳酸铅[2PbCO3Pb(OH)2]是生产铅酸蓄电池正极的原料.
(1)某研究小组制备碱式碳酸铅的主要实验流程如图: 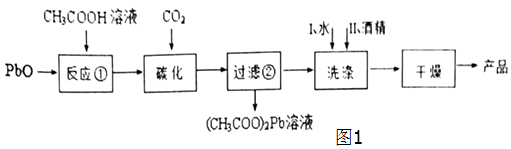 ①“反应①”的生成物是(CH3COO)2PbPb(OH)2 , 该反应是在90℃、搅拌并保温3h的条件下完成的,则该反应的化学方程式为
①“反应①”的生成物是(CH3COO)2PbPb(OH)2 , 该反应是在90℃、搅拌并保温3h的条件下完成的,则该反应的化学方程式为
②过滤时所志要的玻璃仪器有漏斗
③沉淀经水洗涤后又用洒精洗涤的目的是
(2)为确定2PbCO3Pb(OH)2的热分解过程,进行了如下实验: 称取一定量(1)中制得的产品放在热重分析仪中,在氩气流中加热分解,测得残留固体的质量随温度的变化如图所示.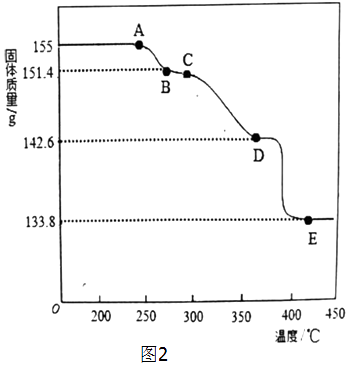
①A→B过程中,逸出的分解产物的化学式为;E点残留固体的化学式为
②根据图中数据,计算并确定D点残留固体的化学式(写出计算过程).
【答案】
(1)2PbO+2CH3COOH ![]() (CH3COO)2Pb?Pb(OH)2;烧杯、玻璃棒;除去沉淀表面附着的水并促进其快速干燥
(CH3COO)2Pb?Pb(OH)2;烧杯、玻璃棒;除去沉淀表面附着的水并促进其快速干燥
(2)H2O; PbO; PbCO3?2PbO
【解析】解:(1)①“反应①”的生成物是(CH3COO)2PbPb(OH)2,该反应是在90℃、搅拌并保温3h的条件下完成的,则该反应的化学方程式为:2PbO+2CH3COOH ![]() (CH3COO)2PbPb(OH)2;
(CH3COO)2PbPb(OH)2;
故答案为:2PbO+2CH3COOH ![]() (CH3COO)2PbPb(OH)2;
(CH3COO)2PbPb(OH)2;
②过滤时所需要的玻璃仪器有漏斗、烧杯、玻璃棒;
故答案为:烧杯、玻璃棒;
③“洗涤”时,经水洗涤后再用酒精洗涤的目的是除去表面的水份同时可以快速干燥,得纯净2PbCO3Pb(OH)2的产品;
故答案为:除去沉淀表面附着的水并促进其快速干燥;(2)①1 mol 2PbCO3Pb(OH)2(用氧化物形式表示为:3PbO2CO2H2O)的质量为775 g
155 g 2PbCO3Pb(OH)2的物质的量为0.2 mol
可以表示为:含PbO 0.6 mol、CO2 0.4 mol、H2O 0.2 mol
而加热过程中Pb元素的质量不变,因此
A→B的过程中,△m1=3.6 g,减少的是0.2 mol H2O,B→D的过程中,△m2=8.8 g,减少的是0.2 mol CO2,D→E的过程中,△m3=8.8 g,减少的是0.2 mol CO2,则E点残留的固体为PbO;
故答案为:H2O;PbO;
②1 mol 2PbCO3Pb(OH)2(用氧化物形式表示为:3PbO2CO2H2O)的质量为775 g
155 g 2PbCO3Pb(OH)2的物质的量为0.2 mol
可以表示为:含PbO 0.6 mol、CO2 0.4 mol、H2O 0.2 mol
而加热过程中Pb元素的质量不变,因此
A→B的过程中,△m1=3.6 g,减少的是0.2 mol H2O
B→D的过程中,△m2=8.8 g,减少的是0.2 mol CO2
D→E的过程中,△m3=8.8 g,减少的是0.2 mol CO2
所以,B点的化学式为2PbCO3PbO,即3PbO2CO2
D点的化学式为PbCO32PbO,即3PbOCO2
答:D点残留固体的化学式为PbCO32PbO.
(1)①“反应①”是由PbO和CH3COOH反应生成的(CH3COO)2PbPb(OH)2反应;
②过滤时所需要的玻璃仪器有漏斗、烧杯、玻璃棒;
③用酒精洗涤,以除去表面的水份同时可以快速干燥,得纯净2PbCO3Pb(OH)2的产品;(2)1 mol 2PbCO3Pb(OH)2(用氧化物形式表示为:3PbO2CO2H2O)的质量为775 g,则155 g 2PbCO3Pb(OH)2的物质的量为0.2 mol,可以表示为:含PbO 0.6 mol、CO2 0.4 mol、H2O 0.2 mol,而加热过程中Pb元素的质量不变,因此
A→B的过程中,△m1=3.6 g,减少的是0.2 mol H2O
B→D的过程中,△m2=8.8 g,减少的是0.2 mol CO2
D→E的过程中,△m3=8.8 g,减少的是0.2 mol CO2
由此计算可得.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】控制变量是科学研究的重要方法。相同质量的铁粉与足量稀硫酸分别在下列条件下发生反应,其中反应速率最快的是
A | B | C | D | |
t/℃ | 10 | 10 | 40 | 40 |
c(H2SO4 )/(mol/L) | 1 | 3 | 1 | 3 |
A. AB. BC. CD. D
【题目】根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+ |
A. 第①组反应的其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子 2 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A. A B. B C. C D. D