��Ŀ����
��15�֣�̼���仯�����й㷺����;��
��1���ڵ绯ѧ�У�����̼���缫���ڼ���п�̸ɵ���У�̼���� ����
��2����ˮ����ͨ�����ȵ�̼���ɲ���ˮú������ӦΪ��C��s��+H2O��g��=CO��g��+H2��g������H=+131.3kJ?mol-1����Ҫ�Ʊ���״����22.4��ˮú����ת�Ƶĵ��ӵ����ʵ���Ϊ ����Ҫ���յ�����Ϊ kJ��
(3����ҵ�ϰ�ˮú���еĻ�����徭��������õĽϴ�H2���ںϳɰ���
N2��g����3H2��g�� 2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��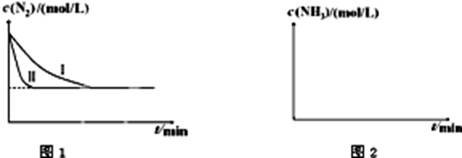
����ʵ���Ƚϣ�ʵ���ı������Ϊ�� ��
��ʵ����ʵ�����¶�Ҫ�ߣ�����������ͬ��������ͼ2�л���ʵ����ʵ�����NH3Ũ����ʱ��仯��ʾ��ͼ��
��4��Na2CO3���ڽ������������ŷ�������CO2�IJ�����1L0.2mol/L Na2CO3��Һ���ձ�״����2.24LCO2����Һ�и�����Ũ���ɴ�С��˳��Ϊ ��
��1������ ��2��1mol ��65.65KJ ��
��3����ʹ�ô��� �� ����4��C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) ��
����4��C(Na+)>C(HCO3-)>C(CO32-)>C(OH-)>C(H+) ��
����

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�(8��) CO2������Ҫ��������,��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�����ش����塣
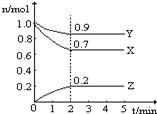
��1����ѧ����H2��CO2�����״�ȼ�ϡ�Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2 L���ܱ������г���1 mol CO2��3��25 mol H2����һ�������·�Ӧ�����CO2��CH3OH(g)��H2O(g)�����ʵ���(n)��ʱ��ı仯��ϵ��ͼ��ʾ��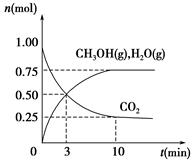
��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________ ����ӷ�Ӧ��ʼ��3 minʱ��������ƽ����Ӧ����v(H2)��____________________��
�����д�ʩ��һ����ʹCO2��ת�����������___________________ ��
A ��ԭ�������ٳ���1 mol H2 B ��ԭ�������ٳ���1 mol CO2
C ��С�������ݻ� D ʹ�ø���Ч�Ĵ���
E����ԭ�����г���1 mol He F����ˮ��������ϵ�з����
��2����ѧ�һ�����������һ���������������̼��Ӧ�����Ҵ�ȼ�ϣ����Ȼ�ѧ��Ӧ����ʽΪ:2CO2(g)��6H2(g)  CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
��3����һ��ѹǿ�£���ø÷�Ӧ��ʵ�����������ʾ������ݱ������ݻش��������⡣
 �¶�(K) �¶�(K) CO2ת����/(%) CO2ת����/(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1��5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�ں����£���Ӧ��ϵ�м�������������÷�Ӧ�ķ�Ӧ��aֵ________(���������С�����䡱)��
����һ���¶��£�����
 ��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)��
��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)�� ��14�֣�
��֪CO(g)+H2O(g) CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
��1���÷�Ӧ�ġ�H 0���<���� >���� =��)��
��2��830��ʱ����һ��5 L���ܱ������г���0.20mol��CO��0.80mol��H2O����Ӧ��ʼ6s��CO��ƽ����Ӧ����v(CO)="0.003" mol��L-1��s-1����6SĩCO2�����ʵ���Ũ��Ϊ ����Ӧ��һ��ʱ��ﵽƽ���CO��ת����Ϊ ��
��3���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b.������ܶȲ���ʱ��ı�
c.c(CO)����ʱ��ı� d.��λʱ��������CO��H2�����ʵ������
��4����֪1000��ʱ��ҪʹCO��ת���ʳ���90%������ʼ��c(H2O): c(CO)Ӧ������ ��
��5��ijȼ�ϵ����COΪȼ�ϣ��Կ���Ϊ��������������̬��K2CO3Ϊ����ʣ���д����ȼ�ϵ�������ĵ缫��Ӧʽ ��
��6����֪CO�������Ʊ��ܶ����ʣ�
 ��H��+8.0kJ��mol��1
��H��+8.0kJ��mol��1 ��H��+90.4kJ��mol��1
��H��+90.4kJ��mol��1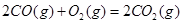 ��H��-556.0kJ��mol��1
��H��-556.0kJ��mol��1 ��H��-483.6kJ��mol��1
��H��-483.6kJ��mol��1���
 ��
�� ��Ӧ����
��Ӧ���� �Ȼ�ѧ����ʽ ��
�Ȼ�ѧ����ʽ �� ��12�֣������ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2����ѧ����ʽ���£�
2NO��2CO 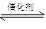 2CO2��N2
2CO2��N2
Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��������崫������ò�ͬʱ���NO��COŨ�����±���
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/ mol��L-1 | 1.00��10-3 | 4.50��10-4 | 2.50��10-4 | 1.50��10-4 | 1.00��10-4 | 1.00��10-4 |
| c(CO)/ mol��L-1 | 3.60��10-3 | 3.05��10-3 | 2.85��10-3 | 2.75��10-3 | 2.70��10-3 | 2.70��10-3 |
��1��д���÷�Ӧ��ƽ�ⳣ������ʽK= ��
��2��ǰ2s�ڵ�ƽ����Ӧ����v(N2)=_____________��
��3�������������·�Ӧ�ܹ��Է����У���Ӧ��
 0�����>������<������=������
0����д��>������<������=��������4���������ܱ������з���������Ӧ���ﵽƽ��ʱ���д�ʩ�����NOת���ʵ��� ��
A.ѡ�ø���Ч�Ĵ��� B.���߷�Ӧ��ϵ���¶�
C�����ͷ�Ӧ��ϵ���¶� D.��С���������
��5���о���������ʹ�õ���������ʱ����������ȱ���������ѧ��Ӧ���ʡ�Ϊ�˷ֱ���֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬����ʵ�������Ѿ���������ʵ����Ʊ��У����ڱ���������ʣ���ʵ����
�����ݡ�
| ʵ���� | T/�� | NO��ʼŨ�� mol��L-1 | CO��ʼŨ�� mol��L-1 | �����ıȱ���� �O��g-1 |
| �� | 280 | 1.2��10-3 | 5.8��10-3 | 82 |
| �� | | | 5.8��10-3 | 124 |
| �� | 350 | 1.2��10-3 | | |
��֪CO2(g)��3H2(g) CH3OH(l)��H2O(l)����H����130.9 kJ��mol��1
CH3OH(l)��H2O(l)����H����130.9 kJ��mol��1
(1)�ֽ�0.8 mol CO2��2.4 mol H2�����ݻ�Ϊ20 L���ܱ������з���������Ӧ������˵����ȷ����__________(����ĸ���)��
| A���÷�Ӧ�ڵ��������Է����� |
| B����������CO2������������㶨ʱ���÷�Ӧ�Ѵ�ƽ��״̬ |
| C���������������䣬ʵ����ƽ�ⳣ����K(T1)��K(T2)����T1��T2 |
| D�����и÷�Ӧ��X��Y���ִ�����X��ʹ����Ӧ���ʼӿ�Լ5��105����Y��ʹ�淴Ӧ���ʼӿ�Լ8��106��(����������ͬ)������������Ӧ��ѡ��XΪ���������� |

������Ӧ������70 s������ͼ1����ʵ����25 s��70 s�ķ�Ӧ�������ߡ�
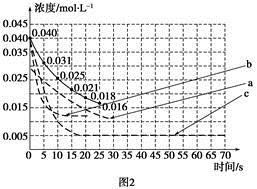
��ij��ѧ��ȤС�����ʵ��Աȷ������ı�ʵ�������Ը÷�Ӧ���̵�Ӱ�죬ÿ��ֻ�ı�һ�����������ɼ���Ӧ������CO2��Ũ�ȱ仯����ԭ�з�Ӧ����ͼ���ϻ��ƶ�Ӧ�����ߡ�ʵ���������±���
| ʵ�� ��� | CO2��ʼ Ũ��/mol��L��1 | ��Ӧ�� ��/�� | ��Ӧѹ ǿ/kPa | �Ƿ���� ���� |
| A | 0.030 | 150 | 101 | �� |
| B | 0.040 | 150 | 101 | �� |
| C | 0.040 | 250 | 101 | �� |
���Ǹ�С�鸺�����ͼ�ߵ�ѧ��δ������(����)��������(��ͼ2)��Ҳ������ע��ÿ����������Ӧ�ı�����������ÿ��ʵ������ͼ2�ж�Ӧ���ߵ���ĸ�������ߡ�
ʵ���š�����������ͼ2����ĸ
A��������������������a
B��������������������b
C��������������������c
 CH3OH(g)��
CH3OH(g)��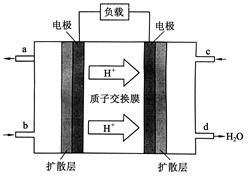
 =4ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��
=4ʱ��CO2��ת������ʱ��ı仯��ϵ��ͼ1��ʾ��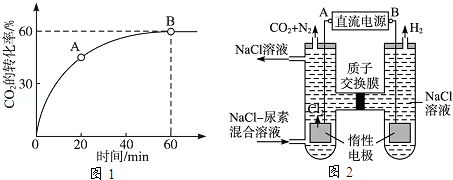
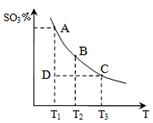
 2SO3(g)�ġ�H____0(�>����<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ����ƶ�������
2SO3(g)�ġ�H____0(�>����<��)�����ں��¡���ѹ������������ƽ����ϵ��ͨ�뺤����ƽ�� �ƶ�������������ҡ����ƶ������� 2CO2��N2�������ŵ��� ��
2CO2��N2�������ŵ��� ��