��Ŀ����
(8��) CO2������Ҫ��������,��ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�����ش����塣
��1����ѧ����H2��CO2�����״�ȼ�ϡ�Ϊ̽���÷�Ӧԭ������������ʵ�飺ij�¶��£����ݻ�Ϊ2 L���ܱ������г���1 mol CO2��3��25 mol H2����һ�������·�Ӧ�����CO2��CH3OH(g)��H2O(g)�����ʵ���(n)��ʱ��ı仯��ϵ��ͼ��ʾ��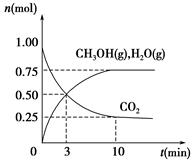
��д���÷�Ӧ�Ļ�ѧ����ʽ_______________________ ����ӷ�Ӧ��ʼ��3 minʱ��������ƽ����Ӧ����v(H2)��____________________��
�����д�ʩ��һ����ʹCO2��ת�����������___________________ ��
A ��ԭ�������ٳ���1 mol H2 B ��ԭ�������ٳ���1 mol CO2
C ��С�������ݻ� D ʹ�ø���Ч�Ĵ���
E����ԭ�����г���1 mol He F����ˮ��������ϵ�з����
��2����ѧ�һ�����������һ���������������̼��Ӧ�����Ҵ�ȼ�ϣ����Ȼ�ѧ��Ӧ����ʽΪ:2CO2(g)��6H2(g)  CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
CH3CH2OH(g)��3H2O(g)����H��a kJ��mol��1��
��3����һ��ѹǿ�£���ø÷�Ӧ��ʵ�����������ʾ������ݱ������ݻش��������⡣
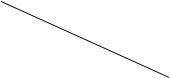 �¶�(K) �¶�(K) CO2ת����/(%) CO2ת����/(%)n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1��5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
�ں����£���Ӧ��ϵ�м�������������÷�Ӧ�ķ�Ӧ��aֵ________(���������С�����䡱)��
����һ���¶��£�����
 ��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)��
��ֵ��CO2ת����_________�������Ҵ������ʵ���________(���������С���������䡱����ȷ����)��
��1�� �� CO2 ��3H2 CH3OH ��H2O ��0��375 mol��L��1��min��1����A��C��F��
CH3OH ��H2O ��0��375 mol��L��1��min��1����A��C��F��
��2�� ��С�� ���ڲ��� ������������
���������������1���ٸ�������ɵø÷�Ӧ�Ļ�ѧ����ʽ��CO2 ��3H2  CH3OH ��H2O��V(CO2)=(1��00-0��25)mol��2L��3min=0��125mol/(L��min),V(H2)="3" V(CO2)=0��375mol/(L��min), ��A������Ӧ���Ũ�ȿ���ʹƽ�������ƶ�����˿������CO2��ת���ʣ���ȷ��B����ԭ�������ٳ���1 mol CO2,ƽ�������ƶ�������ƽ���ƶ�������ԶС�ڼ����������CO2��ת���ʷ������ͣ�����C����С�������ݻ���������ѹǿ��ƽ�������������С�ķ���������Ӧ�����ƶ����ʿ������CO2��ת���ʣ���ȷ��D��ʹ�ø���Ч�Ĵ��������Լӿ췴Ӧ���ʣ����Dz���ʱƽ���ƶ���CO2��ת���ʲ��䣬����E����ԭ�����г���1 mol He�����ڷ�Ӧ������и���ֵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ�������F����ˮ��������ϵ�з���������С���������Ũ�ȣ�ƽ�������ƶ�����˿������CO2��ת���ʣ���ȷ����2�����ڼ������ʵ����ı���ͬʱ�����������¶ȣ�CO2ת���ʽ��ͣ�˵�������¶ȣ�ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ���������ȷ�Ӧ�����Ը÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����������Ӧ��a<0�� �ں����£���Ӧ��ϵ�м��������������¶Ȳ��䣬��÷�Ӧ�ķ�Ӧ��aֵ���䣬����һ���¶��£�����
CH3OH ��H2O��V(CO2)=(1��00-0��25)mol��2L��3min=0��125mol/(L��min),V(H2)="3" V(CO2)=0��375mol/(L��min), ��A������Ӧ���Ũ�ȿ���ʹƽ�������ƶ�����˿������CO2��ת���ʣ���ȷ��B����ԭ�������ٳ���1 mol CO2,ƽ�������ƶ�������ƽ���ƶ�������ԶС�ڼ����������CO2��ת���ʷ������ͣ�����C����С�������ݻ���������ѹǿ��ƽ�������������С�ķ���������Ӧ�����ƶ����ʿ������CO2��ת���ʣ���ȷ��D��ʹ�ø���Ч�Ĵ��������Լӿ췴Ӧ���ʣ����Dz���ʱƽ���ƶ���CO2��ת���ʲ��䣬����E����ԭ�����г���1 mol He�����ڷ�Ӧ������и���ֵ�Ũ�Ȳ��䣬����ƽ�ⲻ�����ƶ�������F����ˮ��������ϵ�з���������С���������Ũ�ȣ�ƽ�������ƶ�����˿������CO2��ת���ʣ���ȷ����2�����ڼ������ʵ����ı���ͬʱ�����������¶ȣ�CO2ת���ʽ��ͣ�˵�������¶ȣ�ƽ�������ƶ�������ƽ���ƶ�ԭ���������¶ȣ�ƽ�������ȷ�Ӧ�����ƶ����淴Ӧ���������ȷ�Ӧ�����Ը÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ�����������Ӧ��a<0�� �ں����£���Ӧ��ϵ�м��������������¶Ȳ��䣬��÷�Ӧ�ķ�Ӧ��aֵ���䣬����һ���¶��£����� ��ֵ������������һ�ַ�Ӧ���Ũ�ȣ�����ʹ�������ʵ�ת���������CO2ת������������ƽ�������ƶ������������Ҵ������ʵ�������
��ֵ������������һ�ַ�Ӧ���Ũ�ȣ�����ʹ�������ʵ�ת���������CO2ת������������ƽ�������ƶ������������Ҵ������ʵ�������
���㣺���黯ѧ��Ӧ���ʵļ��㡢�������ת���ʵĴ�ʩ����Ӧ�ȵ��жϵ�֪ʶ��

 ��ѧȫ��������ѵ��ϵ�д�
��ѧȫ��������ѵ��ϵ�д���10�֣�800�桢2L�ܱ�������Ӧ2NO(g)��O2(g) 2NO2(g)��ϵ�У� n(NO)��
2NO2(g)��ϵ�У� n(NO)��
ʱ��ı仯�����
| ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
��1����Ӧ���е�2 sʱc (NO)= ��
��2����O2��ʾ��0��2s�ڸ÷�Ӧ��ƽ�����ʦԣ�___________��
 ��3�� ��Ӧ�ﵽƽ��״̬ʱNO��ת����= ������ʾ �� ��
��3�� ��Ӧ�ﵽƽ��״̬ʱNO��ת����= ������ʾ �� ����4���ж�һ���淴Ӧ�Ƿ�ﵽƽ��״̬�������кܶ࣬ijͬѧ��Ը÷�Ӧ���һ�����룺�ⶨ������������ܶȣ����ܶȲ��ٸı�ʱ�����жϳ��÷�Ӧ�Ѿ��ﵽƽ��״̬������Ϊ���������Ƿ���ȷ�� ����ǡ�����˵��������� ��
(14��)�ҹ��зḻ����Ȼ����Դ������Ȼ��Ϊԭ�Ϻϳ����ص���Ҫ��������ͼ��ʾ��ͼ��ijЩת��
���輰������δ�г�����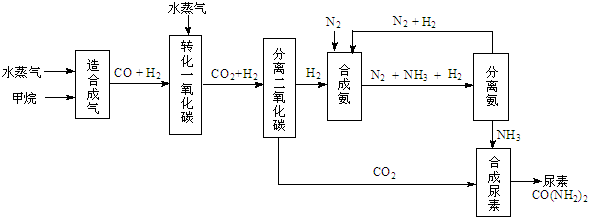
��1������ϳ������������Ȼ�ѧ����ʽ��CH4(g)+H2O(g)  CO(g)+3H2(g)����H��0
CO(g)+3H2(g)����H��0
�ں��º��ݵ������£������CH4�ķ�Ӧ���ʺ�ת���ʣ����д�ʩ���е��� ��
A������ѹǿ B�������¶� C������He�� D������ˮ����Ũ��
| �¶�/�� | 400 | 500 | 800 |
| ƽ�ⳣ��K | 9.94 | 9 | 1 |
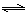 H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£�
H2(g)+CO2(g)���÷�Ӧƽ�ⳣ�����¶ȵı仯���£������̼��[ n��H2O��/n��CO��]��Kֵ ������������䡱��С���������÷�Ӧ��400��ʱ���У���ʼͨ������ʵ�����H2O��CO����Ӧ���е�ijһʱ��ʱCO��CO2��Ũ�ȱ�Ϊ1��3����ʱv������ v���棩�����������������������
��3���йغϳɰ���ҵ��˵������ȷ���� ��
A���÷�Ӧ�����˹��̵�
B���ϳɰ���ҵ��ʹ�ô�������߷�Ӧ���������
C���ϳɰ���Ӧ�¶ȿ�����500�����ң�Ŀ����ʹ��ѧƽ��������Ӧ�����ƶ�
D���ϳɰ���ҵ����ѭ����������Ҫԭ����Ϊ�˼ӿ췴Ӧ����
��4���������ع����У�������n(NH3)��n(CO2)��������Ϊ ����ʵ�����������У�����ʹn(NH3)��n(CO2)��3��������Ϊ ��
��5��������ϳɰ�����ת����Ϊ60��ʱ����3.0��108 L����Ϊԭ���ܹ��ϳ� L ������������������ڱ�״���²ⶨ��
��֪��N2O4(g)  2NO2(g) ��H="+57.20kJ" �� mol-1
2NO2(g) ��H="+57.20kJ" �� mol-1
��100��ʱ����0.100molN2O4�������1L���ݳ�յ��ܱ������У�ÿ��һ��ʱ��Ը������ڵ�����Ũ�Ƚ��з����õ��±����ݣ�
| ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
| c(N2O4) /mol����L-1 | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2) /mol��L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
��1�� �÷�Ӧ��ƽ�ⳣ������ʽΪ ______���ӱ������ݷ�����
c1 c2 (�>�� ����<�� ��="��" ����
��2������������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬����
A��������ѹǿ���ٷ����仯
B��NO2������������ٷ����仯
C������������ԭ���������ٷ����仯
D����ͬʱ��������n mol N2O4��ͬʱ����2n mol NO2
E����Ӧ��ϵ��NO2��N2O4�������Ϊ1:2
��3������ʼʱ����NO2����0.200mol����ﵽƽ��ʱNO2�����ת����Ϊa��������������ʱ�����д�ʩ�����NO2ת���ʵ��� (����ĸ����
A�������¶ȡ���
B����СNO2��Ũ�ȡ���
C�������¶�
D������NO2��Ũ�ȡ���
E���ٳ���һ������He
 2C(g)�� ��H��0��2min��Ӧ�ﵽƽ�⣬����CΪ1.6mol�������з�����ȷ���� �� ��
2C(g)�� ��H��0��2min��Ӧ�ﵽƽ�⣬����CΪ1.6mol�������з�����ȷ���� �� ��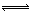 NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I��
NaNO3��s��+ClNO��g�� K1 ?H < 0 ��I�� Fe(s)��CO2(g)��ƽ�ⳣ��K��0.25��
Fe(s)��CO2(g)��ƽ�ⳣ��K��0.25��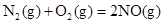
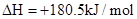
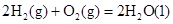
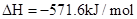
 xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������
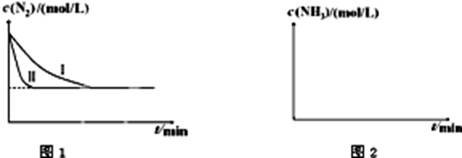
xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������ 2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��