��Ŀ����
��14�֣�
��֪CO(g)+H2O(g) CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
CO2(g)+H2(g)��Ӧ��ƽ�ⳣ�����¶ȵĹ�ϵ���£�
| |�¶�/ �� | 700 | 800 | 830 | 1000 | 1200 |
| ƽ�ⳣ�� | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
��1���÷�Ӧ�ġ�H 0���<���� >���� =��)��
��2��830��ʱ����һ��5 L���ܱ������г���0.20mol��CO��0.80mol��H2O����Ӧ��ʼ6s��CO��ƽ����Ӧ����v(CO)="0.003" mol��L-1��s-1����6SĩCO2�����ʵ���Ũ��Ϊ ����Ӧ��һ��ʱ��ﵽƽ���CO��ת����Ϊ ��
��3���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ (����ȷѡ��ǰ����ĸ)��
a��ѹǿ����ʱ��ı� b.������ܶȲ���ʱ��ı�
c.c(CO)����ʱ��ı� d.��λʱ��������CO��H2�����ʵ������
��4����֪1000��ʱ��ҪʹCO��ת���ʳ���90%������ʼ��c(H2O): c(CO)Ӧ������ ��
��5��ijȼ�ϵ����COΪȼ�ϣ��Կ���Ϊ��������������̬��K2CO3Ϊ����ʣ���д����ȼ�ϵ�������ĵ缫��Ӧʽ ��
��6����֪CO�������Ʊ��ܶ����ʣ�
 ��H��+8.0kJ��mol��1
��H��+8.0kJ��mol��1 ��H��+90.4kJ��mol��1
��H��+90.4kJ��mol��1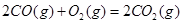 ��H��-556.0kJ��mol��1
��H��-556.0kJ��mol��1 ��H��-483.6kJ��mol��1
��H��-483.6kJ��mol��1���
 ��
�� ��Ӧ����
��Ӧ���� �Ȼ�ѧ����ʽ ��
�Ȼ�ѧ����ʽ ��
��ÿ��2�֣�
��1�� < ��2�֣� ��2��0.018 mol��L-1 80% ����2�֣� ��3��c d��2�֣�
��4��14.4��2�֣�
��5��������O2 + 4e- + 2CO2 = 2CO32-��2�֣�
��6��S��g��+O2��g��= SO2��g�� ��H=-574.0kJmol-1��2�֣�
���������������1���ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС��˵�������¶�ƽ�����淴Ӧ�ƶ���������Ӧ�Ƿ��ȷ�Ӧ������H��0��
��2����Ӧ��ʼ6s��A��ƽ����Ӧ����v��CO��=0.003mol?L-1?s-1����6s��c��CO2��=��c��CO��=0.003mol?L-1?s-1��6s=0.018mol?L?1��CO����ʼŨ��=0.2mol/5L=0.04mol?L?1��
��ƽ��ʱA��Ũ�ȱ仯��Ϊx����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼ��mol/L����0.04 0.16 0 0
�仯��mol/L����x x x x
ƽ�⣨mol/L����0.04-x 0.16-x x x
��x?x/(0.04?x)(0.16?x) =1�����x=0.032mol/L������ƽ��ʱA��ת����=0.032mol/L ��0.04mol?L?1��100%=80%
��3��a���÷�Ӧǰ����������ʵ������䣬ѹǿʼ�ղ��䣬��ѹǿ����ʱ��ı䣬����˵������ƽ�⣬����b�������������������䣬�������ݻ����䣬�ʻ��������ܶ�ʼ�ղ��䣬��������ܶȲ���ʱ��ı䣬����˵������ƽ�⣬����c�����淴Ӧ����ƽ��ʱ������ֵ�Ũ�Ȳ������仯����c��CO������ʱ��ı䣬˵������ƽ�⣬��ȷ��d����λʱ��������CO��H2�����ʵ�����ȣ�����Ӧ���ʵ����淴Ӧ���ʣ�˵������ƽ�⣬��ȷ��
��4����CO��H2O����ʼŨ�ȷֱ�Ϊx��y����CO��ת����Ϊ90%����
CO��g��+H2O��g��?CO2��g��+H2��g��
��ʼŨ�ȣ�mol?L-1�� x y������ 0������0
ת��Ũ�ȣ�mol?L-1�� 0.9x ��0.9x 0.9x�� 0.9x
ƽ��Ũ�ȣ�mol?L-1�� 0.1x�� y-0.9x�� 0.9x�� 0.9x
K=0.9x?0.9x ��[0.1x?(y?0.9x)] =0.6����y/x=14.4��ֻҪ����H2O�����Ϳ����CO��ת���ʡ�
��5���õ���У�������Ӧһ���������õ��ӵĹ��̣��õ�صĵ���ʻ���������̼���Σ����Ե缫��ӦΪ��O2+2CO2+4e-=2CO32- ����2O2+4CO2+8e-=4CO32-��
��6�����ݸ�˹���ɣ�S��g��+O2��g��=SO2��g��������֪��Ӧ����+��-��-�ڣ�/2�õ�����S��g����O2��g����Ӧ����SO2��g���Ȼ�ѧ����ʽΪ��S��g��+O2��g��=SO2��g����H=-574.0kJmol-1��
���㣺���⿼�黯ѧƽ���жϼ��ƶ���������ѧ��Ӧ���ʡ�ԭ���ԭ�����Ȼ�ѧ����ʽ��д��

��16�֣�̼���仯��������������������������ء���ش��������⣺
��1���ڻ������������У�����CO�Ĵ��ڻ���������ж���Ϊ�˷�ֹ�����ж�������SO2��CO����SO2����ԭΪS��
��֪�� C(s)+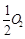 ��g��=CO��g����H1=-126��4kJ/mol ��
��g��=CO��g����H1=-126��4kJ/mol ��
C(s)+O2��g��=CO2��g�� ��H2= ��393��5kJ��mol��1 ��
S(s)+O2��g��=SO2��g�� ��H3= ��296��8kJ��mol��1 ��
��SO2����CO���Ȼ�ѧ��Ӧ����ʽ��
��2��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)+2H2(g) CH3OH(g)��
CH3OH(g)��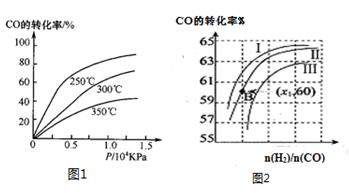
��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ1��ʾ���÷�Ӧ��H 0���>���� <������
ͼ2��ʾCO��ת��������ʼͶ�ϱ�[ n(H2)/n(CO)]���¶ȵı仯��ϵ������I��II��III��Ӧ��ƽ�ⳣ���ֱ�ΪK1��K2��K3����K1��K2��K3�Ĵ�С��ϵΪ �����B(X1,60)��������ת����Ϊ40%����x1= ��
���ں����ܱ������ﰴ�����Ϊ1:2����һ����̼��������һ�������·�Ӧ�ﵽƽ��״̬�����ı䷴Ӧ��ijһ�����������б仯��˵��ƽ��һ��������Ӧ�����ƶ����� ������ţ���
| A������Ӧ������������С | B���淴Ӧ������������С |
| C����ѧƽ�ⳣ��Kֵ���� | D����Ӧ�������ٷֺ������� |
��һ�������£���2molCO��2molH2�����ݻ�Ϊ2L�̶����ܱ������з���������Ӧ����Ӧ�ﵽƽ��ʱCO��H2���֮��Ϊ2��1����ƽ�ⳣ��K�� ��
��3�������о����֣��ø�Ĥ��ⷨ���Դ�����Ũ����ȩ��ˮ��
ԭ����ʹ�ö��Ե缫��⣬��ȩ�ֱ�����������ת��Ϊ�Ҵ������ᣬ
�ܷ�ӦΪ:2CH3CHO+H2O
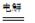 CH3CHOH+CH3CHOOH��
CH3CHOH+CH3CHOOH��ʵ�����У���һ��Ũ�ȵ���ȩ-Na2SO4��ҺΪ�������Һ��ģ����ȩ��ˮ�� �������̣���װ��ʾ��ͼ��ͼ��ʾ��
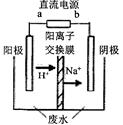
�ٵ������У��������ֱ�����������Ҵ��⣬��������ɫ���壬�����缫��Ӧ�ֱ�Ϊ��
4OH��-4e���TO2��+2H2O�� ��
����ʵ�ʹ��մ��������У���������ȩ��ȥ���ʿɴ�60%�������������ֱ�ע��1m3��ȩ�ĺ���Ϊ300mg/L�ķ�ˮ���ɵõ��Ҵ� kg(����������2λС����
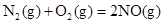
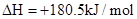
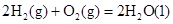
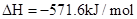
 xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������
xC(g)+2D(g)����5 min���D��Ũ��Ϊ0.5 mol��L��C��ƽ����Ӧ����Ϊ0.1 mol��(L��min)������ CaO(s) + SO2(g) + CO2(g) ��H1=218.4kJ��mol-1(��Ӧ��)
CaO(s) + SO2(g) + CO2(g) ��H1=218.4kJ��mol-1(��Ӧ��) 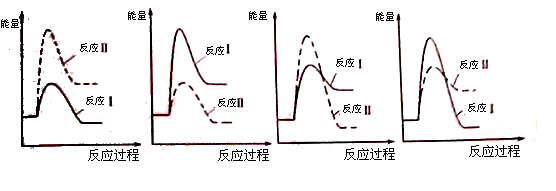
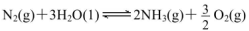
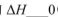 ���>����<����=������
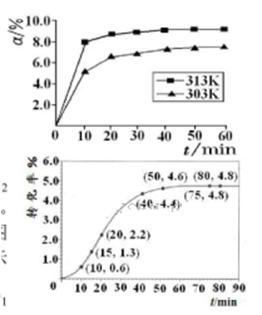
���>����<����=������
 ������0.2 mol
������0.2 mol ��25��ʱ��NH3.H2O�ĵ��볣��
��25��ʱ��NH3.H2O�ĵ��볣��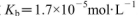 ��
�� ��
��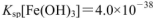 ��
�� Ph��CH��CH2(g)+H2(g) ��H
Ph��CH��CH2(g)+H2(g) ��H
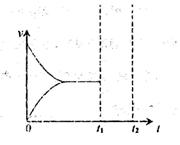
 2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��
2NH3��g������H=-92.4kJ?mol-1����ͼ1�������ֲ�ͬʵ��������ģ�⻯����������ʵ�������N2��ʱ��仯ʾ��ͼ��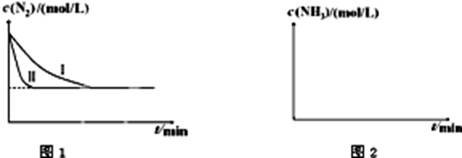
 2NH3(g) ��H����92.4 kJ/mol���ݴ˻ش��������⣺
2NH3(g) ��H����92.4 kJ/mol���ݴ˻ش��������⣺