题目内容
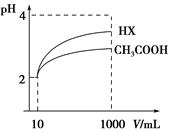
常温下,将pH和体积都相同的盐酸和醋酸溶液分别加蒸馏水稀释,pH随溶液体积变化如图,下列有关叙述正确的是


| A.曲线I为醋酸稀释时pH值变化曲线 |
| B.a点时,若都加入相同大小的锌粒,此时盐酸反应的速率大 |
| C.a点时,若都加入足量的锌粒,最终与醋酸反应产生的氢气多 |
| D.b点溶液中水的电离程度比c点溶液中水的电离程度小 |
C
试题分析:稀释能促进弱酸电离平衡向电离方向移动,则稀释相同倍数时,盐酸pH的变化程度大于醋酸,所以图中I表示盐酸,II表示醋酸,故A错误;Zn+2H+=Zn2++H2↑,a点时盐酸和醋酸的pH相同,则c(H+)相同,因此反应速率相等,故B错误;a点时盐酸和醋酸的c(H+)相同,但前者的电离程度大于后者,则c(HCl)<c(CH3COOH),因此n(HCl)<n(CH3COOH),所以醋酸与足量锌粒反应放出的氢气多,故C正确;H2O
 H++OH-,b点的pH大于c点的pH,则b点的c(H+)小于c点的c(H+),酸电离出的c(H+)越大,水的电离平衡越向左移动,水的电离程度越小,则b点水的电离程度大于c点,故D不正确。
H++OH-,b点的pH大于c点的pH,则b点的c(H+)小于c点的c(H+),酸电离出的c(H+)越大,水的电离平衡越向左移动,水的电离程度越小,则b点水的电离程度大于c点,故D不正确。
练习册系列答案
相关题目
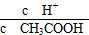 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.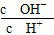

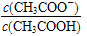 变大
变大