题目内容
将78 g金属钾在空气中燃烧,生成KO2和K2O2的混合物。该混合物与足量的CO2充分反应后生成O2(4KO2+2CO2→2K2CO3+3O2),得到O2的物质的量可能为
| A.0.50 mol | B.0.75 mol | C.1.00 mol | D.1.50 mol |
BC
解析试题分析:78g钾的物质的量78g÷39g/mol=2mol,如果全部生成KO2,则KO2的物质的量是2mol。根据反应方程式4KO2+2CO2→2K2CO3+3O2可知,生成氧气的物质的量是1.5mol。如果全部生成K2O2,则K2O2的物质的量是1mol,则根据方程式2 K2O2+2CO2→2K2CO3+O2可知,生成氧气的物质的量是0.5mol,因此最终生成氧气的物质的量应该介于0.5mol和1.5mol之间,答案选BC。
考点:考查钾的燃烧产物与CO2反应的有关计算

2008年5月我国汶川发生地震灾害,假若你是卫生防疫人员,为配制0.01 mol/L的KMnO4消毒液,下列操作导致所配溶液浓度偏高的是
| A.取KMnO4样品时不慎在表面沾了点蒸馏水 |
| B.溶解搅拌时有液体飞溅 |
| C.定容时俯视容量瓶刻度线 |
| D.摇匀后见液面下降,再加水至刻度线 |
室温时在实验室里将1.12 L H2S(g)通入1L某浓度的烧碱溶液中,恰好完全反应,测得
溶液的pH=10(体积变化忽略不计),正确的推断是(NA代表阿伏加德罗常数)
| A.硫化氢的分子数目约为0.05NA个 | B.原烧碱溶液中约含溶质微粒0.1NA个 |
| C.反应后溶液中约含OH- 1×10-4NA个 | D.反应后溶液中约含S2- 0.05NA个 |
阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是
| A.1 L 1 mol?L-1的HAc溶液中含有氢离子数约为6.02×1023 |
| B.18 g D2O(重水)完全电解,转移的电子数约为6.02×1023 |
| C.标态下,22.4L NO2气体,所含氧原子数约为2×6.02×1023 |
| D.标态下,14g乙烯和丙烯的混合物中,含有共用电子对数目约为3×6.02×1023 |
向Cu和Cu2O的混合物27.2g中加入某浓度的硝酸0.1L,固体物质完全反应,生成NO2、 N2O4、NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,溶液恰好呈中性,金属离子也已完全沉淀,沉淀质量为39.2g。以下所得结论不合理的是
| A.硝酸的物质的量浓度为12.0mol/L |
| B.产生的气体在标准状况下的体积为13.44L |
| C.Cu与Cu2O 的物质的量之比为2:1 |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
铜和镁的合金2.3 g完全溶于浓HNO3,若反应中硝酸被还原只产生2.240 L的NO2气体和168 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生产沉淀的质量为
| A.4.1275g | B.4.255 g | C.8.51 g | D.9.62 g |
设NA为阿伏加德罗常数,下列叙述中正确的是( )
| A.同温同压下,原子数均为NA的氢气和氦气具有相同的体积 |
| B.室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA |
C.常温常压下,1mol甲基(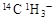 )所含的中子数和电子数分别为8NA、9NA )所含的中子数和电子数分别为8NA、9NA |
| D.在密闭容器中加入28g N2和6g H2,在高温、高压、催化剂的条件下充分反应, |
NA表示阿伏加德罗常数,下列叙述中正确的是
| A.标准状况下2.24 L三氯甲烷含有分子数目为0.1 NA |
| B.1mol18O2、16O3混合气体中定含有40NA个质子 |
| C.常温下,100 mL 1 mol·L—1的Na2CO3溶液中的阴离子数目大于0.1NA |
| D.3.2 g硫与铜充分反应,电子转移总数为0.1NA |
下列化学用语表示正确的是 ( )
A.含18个中子的氯原子的核素符号: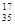 C1 C1 |
B.氟原子结构示意图: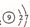 |
| C.1 -丙醇的结构简式:C3 H7OH |
D.CO( NH2)2的电子式: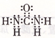 |