题目内容
铜和镁的合金2.3 g完全溶于浓HNO3,若反应中硝酸被还原只产生2.240 L的NO2气体和168 mL的N2O4气体(都已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生产沉淀的质量为
| A.4.1275g | B.4.255 g | C.8.51 g | D.9.62 g |
B
解析试题分析:
根据氧化还原反应,化合价升降数相等。
H NO3 —— NO2 2H NO3——-- N2O4
0.1 2.24/22.4 0.015 0.168/22.4
化合价降低总数:0.1+0.015=0.115
解:设镁和铜的物质的量为x和y
Mg—Mg2+ --Mg(OH)2 Cu-Cu2+- Cu(OH)2
x x y y
根据化合价升降数相等2x+2y=0.115 24x+64y=2.3 x= 0.0345 y=0.023
生成沉淀:58x+98y=4.255 (g) 选B。
考点:考查化学计算等相关知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设阿伏加德罗常数的值为NA,下列说法正确的是
| A.在常温常压下,11.2LN2含有的分子数为0.5NA |
| B.在常温常压下,1molH2含有的原子数为2NA |
| C.0.1mol/LNaCl溶液中含有Na+数目为0.1NA |
| D.在同温同压时,相同体积的任何气体含有相同数目的原子 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.标准状况下,33.6L氟气中含有氟原子的数目为1.5NA |
| B.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA |
| C.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2NA |
| D.50mL18.4mol·L-1浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA |
下列微粒中,对水的电离平衡不产生影响的是
A. | B.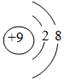 | C.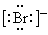 | D.1s22s22p63s1 |
将78 g金属钾在空气中燃烧,生成KO2和K2O2的混合物。该混合物与足量的CO2充分反应后生成O2(4KO2+2CO2→2K2CO3+3O2),得到O2的物质的量可能为
| A.0.50 mol | B.0.75 mol | C.1.00 mol | D.1.50 mol |
Fe2O3、ZnO、CuO的固体混合粉末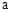 克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为( )
克,在加热条件下用足量CO还原,得到金属混合物2.41克,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00克白色沉淀,则a的数值为( )
| A.7.41 | B.3.59 | C.3.21 | D.2.46 |
用NA表示阿伏加德罗常数,下列叙述正确的是
| A.46 g乙醇中含有的化学键数为7 NA |
| B.1 mol氯气和足量NaOH溶液反应转移电子数为2 NA |
| C.1 mol OH-和1 mol -OH(羟基)中含有的质子数均为 9 NA |
| D.10 L 0.1 mol·L-1的Na2CO3溶液中,Na+、CO2- 3总数为3 NA |
设NA为阿伏加德罗常数的值。下列说法中正确的是
| A.在密闭容器中加入1 mol N2和3 mol H2,充分反应生成NH3分子数为2NA |
| B.标准状况下,4.48 L N2所含的共用电子对数0.2NA |
| C.常温常压下,1 mol NaHSO4晶体中含有2NA个离子 |
| D.标准状况下,1 mol Fe与2.24 L Cl2反应转移的电子数为3NA |
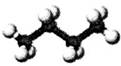
下列有关表示不正确的是
| A | B | C | D |
| 丁烷分子的球棍模型 | 质量数为A,中子数为a的X原子 | 邻羟基苯甲醛分子内氢键 | 放热反应的能量变化 |
 | A aX | 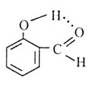 | 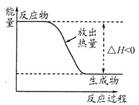 |