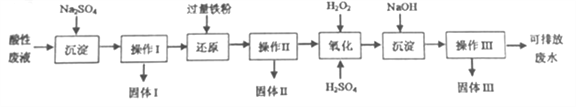
题目内容
【题目】水是极弱的电解质,改变温度或加入某些电解质会影响水的电离。请回答下列问题:
(1)纯水在100 ℃时,pH=6,该温度下0.1 mol·L-1的NaOH溶液的pH=________。
(2)25 ℃时,向水中加入少量碳酸钠固体,得到pH为11的溶液,其水解的离子方程式为_________________,由水电离出的c(OH-)=________ mol·L-1。
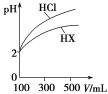
(3)体积均为100 mL、pH均为2的盐酸与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX是________(填“强酸”或“弱酸”),理由是______________________________。
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量。已知:
化学式 | 电离平衡常数(25 ℃) |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
①25 ℃时,等浓度的NaCN溶液、Na2CO3溶液和CH3COONa溶液,溶液的pH由大到小的顺序为________(填化学式)。
②25 ℃时,在0.5 mol·L-1的CH3COOH溶液中由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的________倍。
【答案】(1)11 (2)CO![]() +H2OHCO
+H2OHCO![]() +OH- 10-3 (3)弱酸 稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸 (4)①Na2CO3>NaCN>CH3COONa ②9×108
+OH- 10-3 (3)弱酸 稀释相同倍数,一元酸HX的pH变化量比HCl的小,说明HX存在电离平衡,故HX为弱酸 (4)①Na2CO3>NaCN>CH3COONa ②9×108
【解析】(1)根据题意可知,c(OH-)=0.1 mol·L-1,该温度下,Kw=c(H+)·c(OH-)=10-12,则c(H+)=10-11 mol·L-1,pH=11。(2)碳酸根离子水解的离子方程式为CO![]() +H2OHCO
+H2OHCO![]() +OH-,pH=11说明c(H+)=10-11 mol·L-1,c(OH-)=
+OH-,pH=11说明c(H+)=10-11 mol·L-1,c(OH-)=![]() mol·L-1=10-3 mol·L-1,溶液中的OH-全部是由水电离产生的。(4)①酸的酸性越弱,其对应的盐的水解程度越大,碱性越强,pH越大,由表知酸性:CH3COOH>HCN>HCO
mol·L-1=10-3 mol·L-1,溶液中的OH-全部是由水电离产生的。(4)①酸的酸性越弱,其对应的盐的水解程度越大,碱性越强,pH越大,由表知酸性:CH3COOH>HCN>HCO![]() ,则pH:Na2CO3>NaCN>
,则pH:Na2CO3>NaCN>
CH3COONa。②由CH3COOH的电离平衡常数的定义得Ka(CH3COOH)=![]() =
=![]() =1.8×10-5,c(CH3COOH)≈0.5 mol·L-1,则c(H+)≈3×10-3 mol·L-1,由水电离出的氢离子浓度约为
=1.8×10-5,c(CH3COOH)≈0.5 mol·L-1,则c(H+)≈3×10-3 mol·L-1,由水电离出的氢离子浓度约为![]() mol·L-1,故由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的
mol·L-1,故由CH3COOH电离出的c(H+)约是由水电离出的c(H+)的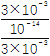 =9×108倍。
=9×108倍。

 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案【题目】(1)下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液退色;②比例模型为 |
B | ①由C和H两种元素组成;②比例模型为 |
C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应;③能与D反应生成相对分子质量为100的酯 |
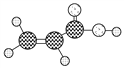
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
①A与Br2的CCl4溶液反应的生成物的名称是________________。
②B不能使溴水因发生化学反应而褪色,B与一定比例浓硫酸和浓硝酸的混合溶液发生反应,为了使反应在50~60 ℃下进行,常用的方法是_____________;反应方程式为: ________________________________,反应类型为:________反应。
③C和D反应生成相对分子质量为100的酯,生成的酯的结构简式:______。
(2)已知: A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;由A通过聚合反应生成高分子化合物F,F可用于工业合成塑料,现以A为主要原料合成G, 以A为原料的合成路线如下图所示。
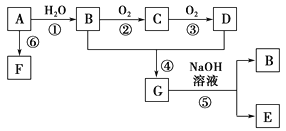
回答下列问题:
①D、G分子中的官能团名称分别__________、___________。
②在反应①~⑥中,属于加成反应的是________,属于取代反应的是________。(填序号)
③写出与G分子式相同的所有羧酸类的同分异构体:_______________。